
Vítejte u druhé části našeho seriálu o epigenetice. V první části jsme popsali, co je epigenetika a nabídli jsme vám přehled různých typů možných epigenetických modifikací. V tomto příspěvku se budeme zabývat metodami, které se používají ke studiu metylace DNA a RNA.
Metylace DNA a RNA
Metylace DNA je jednou z nejintenzivněji zkoumaných epigenetických modifikací, a to jak v rámci výzkumu, tak při diagnostice in vitro, zejména u nádorových onemocnění, kde se rozsáhlé změny metylace DNA často projevují již v raných fázích tumorigeneze. Takové metylace lze detekovat v tekutých biopsiích, které u některých druhů nádorových onemocnění slouží jako nástroj včasného screeningu. Některé testy pro diagnostiku nádorových onemocnění založené na detekci metylované DNA se v klinické praxi používají již dnes.
Zájem o problematiku metylace RNA vzrůstá a mnoho identifikovaných značek RNA přesně odpovídá svým protějškům u DNA, což je dáno podobnou páteřní strukturou DNA a RNA. Obě nukleové kyseliny využívají jako donor metylu tentýž SAM (S-adenosylmethionin) a katalyzátorem metylace jsou metyltransferázy.
Nejrozšířenějšími epigenetickými markery RNA jsou 5-mC a m6A. Výzkumy naznačují, že oba hrají při regulaci stability RNA a translace mRNA určitou roli. Ačkoli funkce metylace RNA není dosud zcela objasněna, nejaktuálnější údaje naznačují, že abnormální metylace RNA má vliv na řadu lidských onemocnění včetně některých druhů nádorových a autoimunitních onemocnění. Úlohu m6A při regulaci mRNA potvrzuje obohacení v nepřekládaných oblastech (UTR) na 3′ konci. Ztráta 5-mC z vaultových RNA způsobuje aberantní zpracování na malé fragmenty RNA spojované s Argonauty, které mohou fungovat jako mikroRNA. Mezi další markery RNA patří N-7 methylguanosin a N-1 methyladenosin.
Studium metylace nukleových kyselin
Metylaci DNA lze zkoumat mnoha způsoby: bisulfitovými a jinými než bisulfitovými metodami konverze i metodami, které jsou založené na detekci protilátek, jako je např. enzymová imunosorbentní analýza (ELISA). Často se používá několik metod současně a zvolená metoda (či metody) se odvíjí (odvíjejí) od požadovaného výsledku, např. zda chce výzkumník získat informace o metylaci v konkrétních lokusech, nebo zda mu postačí celkový obraz o rozsahu metylace v celém genomu.
Metylace RNA se nejčastěji zkoumá pomocí metod bisulfitové konverze, ale existují také ELISA kity ke globální detekci m6A a 5-hmC v RNA.
Jiné než bisulfitové metody konverze a metody založené na detekci protilátek probereme v našem seriálu později, nyní se pojďme blíže podívat na problematiku analýzy metylace nukleových kyselin metodou bisulfitové konverze.
Co je to bisulfitová konverze
Za „zlatý standard“ analýzy metylace DNA se považuje bisulfitová úprava neboli konverze, která se pokládá za nejvhodnější a nejúčinnější způsob mapování metylace DNA a RNA ke konkrétním nukleotidům.
Začíná se s izolovanou purifikovanou DNA bez RNA, příp. RNA bez DNA, která se poté podrobí třístupňové chemické reakci, k níž dochází mezi cytosiny přítomnými ve vzorku nukleové kyseliny a hydrogensiřičitanem sodným, jenž se do reakce přidává.
Bisulfitová konverze vede k přeměně nemetylovaných cytosinů na uracil. Na obr. 1 jsou znázorněny obecné kroky chemické reakce, které se podílejí na typické reakci při bisulfitové konverzi.
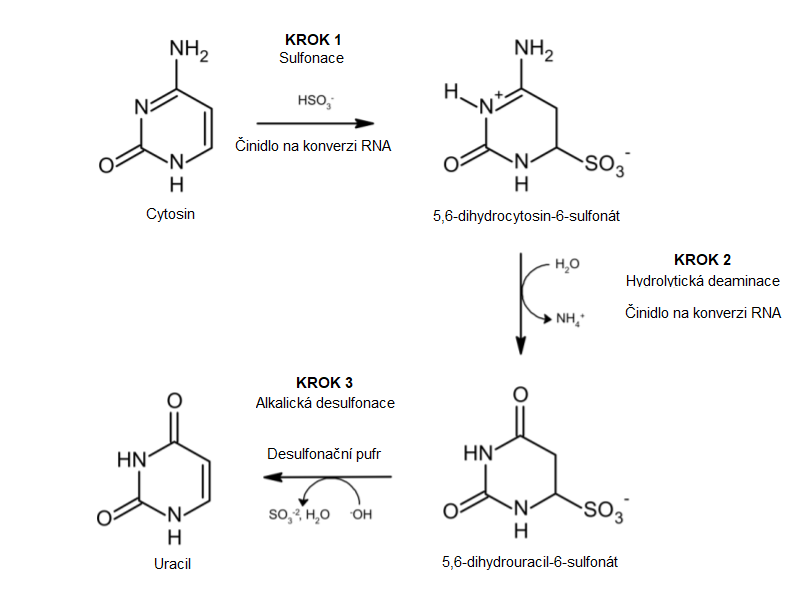
Obr. 1: Kroky chemické reakce, které se podílejí na typické reakci při bisulfitové konverzi.
Nemetylované cytosiny se přeměňují na uracil. Mezi typické vstupy u DNA patří purifikovaná genomická DNA, DNA štěpená endonukleázami a linearizovaná plazmidová DNA. U RNA jsou typickými vstupy RNA a mRNA. Obrázek použit se svolením společnosti Zymo Research.
Půvab bisulfitové konverze tkví v tom, že na uracil mohou být přeměněny pouze nemodifikované (tj. nemetylované) cytosiny, zatímco metylované cytosiny jsou před konverzí chráněny. Výslednou DNA nebo RNA lze poté analyzovat metodou PCR s následným sekvenováním, hybridizací, metylačně-specifickou PCR (MSP), pyrosekvenováním čili sekvenováním nové generace, a zmapovat tak pozice metylovaných cytosinů v původním vzorku (obr. 2).
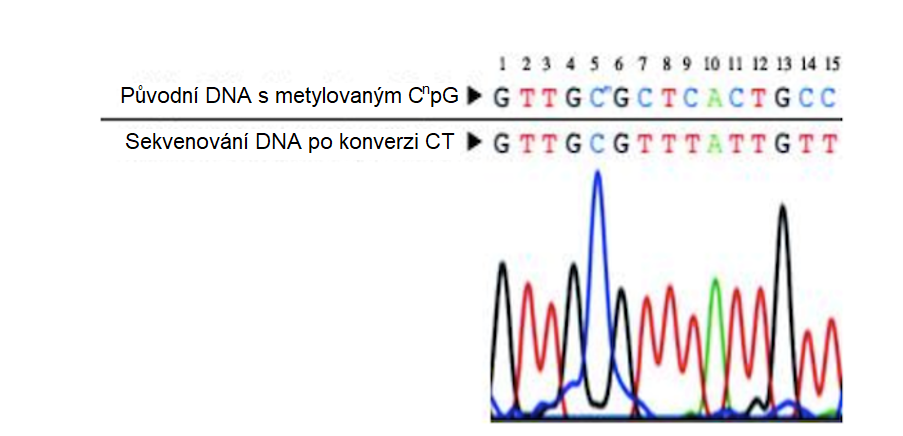
Obr. 2: Příklad chromatogramu sekvenování DNA po ošetření vzorků bisulfitem.
Původní vzorek byl podroben bisulfitové konverzi pomocí soupravy EZ DNA Methylation™ Kit (Zymo Research). Výsledná DNA byla amplifikována metodou PCR a následně sekvenována. Metylovaný cytosin na 5′ pozici zůstává cytosinem, zatímco nemetylované cytosiny na 7′, 9′, 14′ a 15′ pozici se přeměnily na uracil. Povšimněme si, že po PCR jsou detekovány jako thymin. Obrázek použit se svolením společnosti Zymo Research.
Manipulace se vzorky ošetřenými bisulfitem
Proces chemické konverze je poměrně drsný a dramaticky mění fyzikálně-chemické vlastnosti vzorku nukleové kyseliny. Vzorky nukleové kyseliny mají po ošetření bisulfitem podobu směsi náhodně fragmentovaných jednovláknových molekul. Tyto změny mohou ovlivnit celkovou kvalitu a regeneraci nukleové kyseliny, a musí být tudíž zvažovány v kontextu následných analýz a nároků. Proto se před další analýzou důrazně doporučuje důkladné posouzení kvality ošetřené DNA/RNA.
Kvalitu lze posoudit pomocí elektroforézy, spektrofotometrie nebo fluorometrických metod popsaných a srovnávaných např. v článku o kvalitě RNA (většina skutečností platí též pro DNA). Přesto je třeba určité informace poupravit:
- Je-li ke kvantifikaci DNA použit spektrofotometr, při vlnové délce 260 nm je absorbance roztoku rovna 1 a měla by být zadána hodnota 40 µg/ml, protože DNA ošetřená bisulfitem připomíná RNA.
- Je-li k posouzení DNA použita elektroforéza v agarózovém gelu, doporučuje se k rozlišení malých fragmentů DNA gel o vysoké hustotě (např. 2%) a marker nízkých molekulových hmotností.
- Aby byly fragmenty DNA viditelné, budete možná muset nechat gel vychladit v ledové lázni. Tím posílíte párování bází mezi jednovláknovými fragmenty, což naopak umožní interkalaci ethidium bromidu či jiného barviva vázajícího dvouvláknovou DNA.
Další analýza: metody na bázi PCR
Existuje mnoho způsobů analýzy nukleových kyselin ošetřených bisulfitem, ale metody založené na PCR jsou zdaleka nejoblíbenější. Patří sem bisulfitová PCR, PCR specifická pro detekci metylace (MSP) a bisulfitové sekvenování či bisulfitová pyrosekvenace, které vyžadují amplifikaci DNA konvertované bisulfitem pomocí PCR. Na bisulfitem ošetřenou RNA lze použít stejné metody, jakmile je reverzně transkribována na komplementární cDNA, která pak slouží jako šablona PCR.
Bisulfitová PCR využívá běžné primery, které dokážou vázat a amplifikovat danou oblast bez ohledu na stav metylace. Tento typ PCR se obvykle používá k vytváření materiálu pro další následnou metodu, jako je hmotnostní spektrometrie, bisulfitové sekvenování či bisulfitová pyrosekvenace, pomocí níž můžeme určit, kde v genomu se nacházejí metylované cytosiny.
MSP se na druhou stranu používá k posouzení stavu metylace v konkrétním místě a opírá se o diferenciální amplifikaci šablony s využitím metylovaných i nemetylovaných primerových sad.
Amplifikace nukleových kyselin ošetřených bisulfitem prováděná pomocí PCR je v důsledku fyzikálně-chemického stavu vzorku po konverzi přirozeně náchylná k chybovosti. Úspěch do značné míry závisí na dobře navržených a testovaných primerech, optimalizovaných podmínkách žíhání (hybridizace primerů) a vhodné polymeráze (např. „hot start“ polymeráza), jež sníží nespecifickou vazbu primeru.
Upozornění:
Jakkoli je bisulfitová konverze elegantní metodou, má několik stinných stránek:
- Bisulfitová konverze neumožňuje diskriminaci různých markerů metylace, např. 5-mC ani 5-hmC nelze přeměnit na uracil.
- Protože je bisulfitová konverze drsným ošetřením, vstupní materiál musí být velice kvalitní, jinak bude mít nevyhnutelná fragmentace nukleové kyseliny, která už tak ovlivňuje regeneraci vzorku, za následek významnou ztrátu materiálu vzorku a potažmo informací.
- Bisulfitová konverze není samostatným postupem. Vždy po ní musí následovat ještě další krok (např. PCR, NGS). Tím se pracovní postup prodlužuje a je náchylný k chybovosti, přičemž volba dalšího kroku nemusí být jednoznačná. Když se například k analýze vzorků ošetřených bisulfitem použije PCR, je pro dosažení spolehlivých výsledků zásadní design primeru a náklady na NGS mohou vzrůst. Pro globální detekci 5-mC, 5hmC, příp. m6-A představují rychlé a účinné řešení metody na bázi protilátek. Budeme se jimi v tomto seriálu zabývat později.
Volba správného nastavení
Volba správné metody ke studiu metylace DNA – a to i v případě rozhodnutí pro bisulfitovou strategii – mnohdy závisí na takových faktorech, jako je úroveň požadované citlivosti, následná analýza, dostupný vstupní materiál a úroveň propustnosti.
Je možno vybírat z mnoha komerčně dostupných souprav k provádění bisulfitové konverze, které se navzájem liší co do bisulfitové konverze, formátu (tj. zkumavky, mikrojamky nebo magnetické kuličky), pracovního postupu a doby analýzy. Některé z těchto souprav nabízejí přímou konverzi ze vzorků krve, zatímco jiné pro větší pohodlí zjednodušují celou konverzi s využitím jediného pufru v rámci jednoho kroku.
(Převzato od společnosti Nordic BioSite, redakčně upraveno.)
Ve třetí části této série se dozvíte víc o způsobech zkoumání metylace nukleových kyselin, které nejsou založeny na bisulfitové konverzi.