Náš seriál o epigenetice pokračuje! V první a druhé části jsme vám představili obor epigenetiky a přístupy ke studiu metylace DNA a RNA založené na metodách bisulfitové konverze. Ve třetí části se zaměříme na způsoby zkoumání metylace nukleových kyselin, které nejsou založeny na bisulfitové konverzi.

Nukleové báze v nukleových kyselinách DNA nebo RNA. Adenin, guanin, thymin a cytosin. Ilustrace s trojrozměrným zobrazením
Zlatým standardem při zkoumání metylace DNA a RNA je sice bisulfitová konverze, ovšem metylaci je možno studovat i bez jejího použití. Existuje řada strategií, z nichž vybíráme podle toho, zda potřebujeme informace o konkrétních lokusech, nebo nám jde o globální obraz, tj. získání informací o metylaci na celogenomové úrovni.
Analýza lokusu nebo globální analýza
Přístupy zaměřené na konkrétní lokusy jsou schopny odhalit, zda dochází nebo nedochází k metylaci jednotlivých bází cytosinu, zatímco globální přístupy lze využít, pokud chceme zjistit, zda celkovou úroveň metylace ovlivňuje určitý typ ošetření, inaktivace (knockout) regulačních genů nebo jejich cílené „umlčování“ (knockdown). Celogenomové přístupy umožňují rozlišení podle jednotlivých bází na celogenomové úrovni. V níže uvedeném schématu je uveden stručný přehled metod, které lze k analýze metylace DNA nebo RNA použít samostatně nebo ve vzájemné kombinaci.
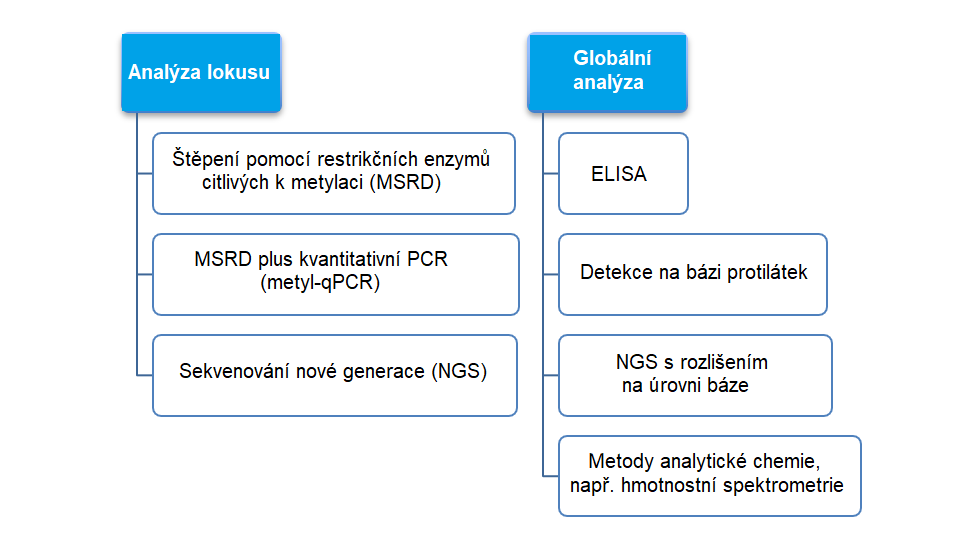
Štěpení pomocí restrikčních enzymů citlivých k metylaci (MSRD)
Tento přístup využívá aktivity restrikčních enzymů citlivých k metylaci (MSRE). Jeho princip je ten, že štěpení metylované a nemetylované DNA pomocí restrikčních enzymů vytváří výrazné pruhování, neboť metylované báze nelze pomocí MSRE rozštěpit.
Nezapomínejme, že konvenční MSRE mezi 5-mC a 5-hmC nerozlišují.
MSRD, po němž následuje elektroforéza v agarózovém gelu, může dále poskytnout kvalitativní informace, protože nám umožňuje porovnat DNA izolovanou ze vzorků ošetřených různým způsobem, nemůže nám však nabídnout rozlišení specifické pro daný lokus.
MSRD a kvantitativní polymerázová řetězová reakce (PCR)
Informace specifické pro jednotlivé lokusy lze získat kombinací MSRD s kvantitativní real-time PCR. V tomto uspořádání se testovaná DNA, např. genomická data ze souboru ošetřených vzorků, rozdělí do dvou alikvotů, z nichž jeden slouží jako zkušební a druhý jako referenční neboli kontrolní.
Zkušební vzorek se štěpí pomocí MSRE, zatímco štěpení referenčního vzorku probíhá simulovaně. DNA z obou alikvotů se poté amplifikuje pomocí real-time PCR za přítomnosti fluorescenčního reportérového barviva vázajícího DNA.
Prahové hodnoty cyklu (Cycle threshold – Ct) pro zkušební a referenční vzorky se budou lišit podle stavu metylace. Jelikož metylovaná DNA je vůči MSRE rezistentní, bude amplifikována robustním způsobem, zatímco nemetylovaná DNA poskytne menší množství produktu PCR. Porovnání metylované a nemetylované DNA po štěpení pomocí MSRE obvykle odhalí velké rozdíly v Ct (obrázek 1).
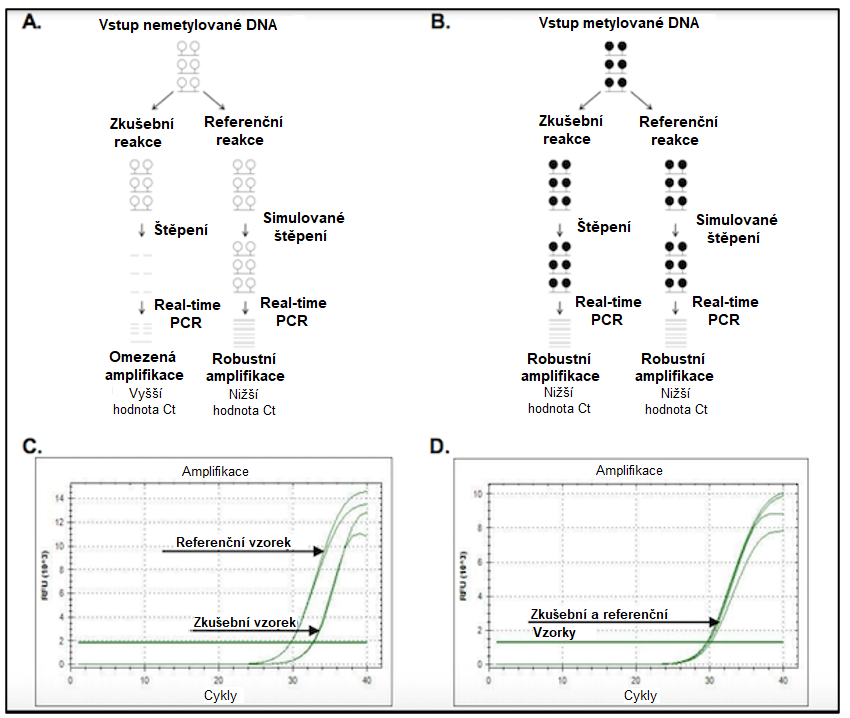
Obrázek 1: Schéma pracovního postupu MSRD. A) nemetylované a B) metylované vzorky DNA se rozdělí do dvou alikvotů: zkušebního a referenčního. Zkušební vzorky se štěpí pomocí MSRE, zatímco referenční vzorky se štěpí simulovaně (tj. se neštěpí). Nemetylovaná DNA se štěpí okamžitě, jak je vyznačeno černými přerušovanými čarami v části A, zatímco metylovaná DNA štěpení nepodléhá. DNA ze všech vzorků se pak použije jako šablona pro real-time PCR. V hodnotách Ct mezi rozštěpenou a referenční nemetylovanou DNA je patrný velký rozdíl, zatímco zkušební a referenční vzorky metylované DNA vykazují obdobné hodnoty Ct. Obrázek použit se svolením společnosti Zymo Research.
V případě potřeby lze před štěpením použít enzym glykosyltransferázu specifickou pro 5-hmC, který specificky označí místa s 5-hmC. Tím se získá modifikovaná báze glykosyl-5-hydroxymetylcytosin (g-5-hmC). Místo MSRE se pak ke štěpení vzorku použije restrikční endonukleáza citlivá ke g-5-hmC (GSRE). GSRE jsou citlivé ke g-5-hmC, což umožňuje specifickou detekci označeného 5-hmC v rámci následné kvantitativní PCR (qPCR).
Uvedené pracovní postupy vyžadují vysoce kvalitní DNA a pro ověření přesnosti a výsledků by měly zahrnovat známé metylované a nemetylované standardy odpovídající příslušnému druhu.
Pro MSRD-qPCR existují komerční kity, které obvykle obsahují pár nebo panely primerů specifických pro daný lokus. Tyto testy lze modifikovat pro studium dalších oblastí, např. promotorů, které jsou předmětem našeho zájmu, navržením a optimalizací primerů specifických pro daný cíl.
Testy metylace za účelem detekce
Asi nejjednodušším způsobem, jak rychle vyhodnotit globální metylaci DNA a porovnat různé typy tkání po různých ošetřeních, např. po přidání léčiva, inaktivaci nebo „umlčení“ genů, u nichž se předpokládá, že hrají roli v epigenetické regulaci, je test na mikrotitračních destičkách podobný testu ELISA. Tyto testy využívají k detekci metylových skupin na nukleových kyselinách protilátky a produkují měřitelné kolorimetrické nebo fluorometrické signály.
K provádění detekce a kvantifikace globálních hladin 5-mC, 5-hmC a 5-formylcytosinu (5fC) ve vzorcích DNA, případně N6-metyladenosinu (m6A) a 5-mC ve vzorcích RNA oproti uvedeným standardům se používá řada komerčních kitů.
Obdobné kity existují také pro detekci a kvantifikaci aktivity enzymů modifikujících DNA a RNA, jako jsou metyltransferázy a demetylázy, které katalyzují přidávání metylových skupin k nukleovým kyselinám a jejich odebírání.
Obdobný přístup jako u testu ELISA lze rozšířit na rychlý screening knihoven sloučenin nebo na genetický screening epigenetických mechanismů.
Detekce na bázi protilátek
Protilátky, které rozpoznávají metylované báze, se používají v kombinaci s imunoanalytickými metodami, jako jsou ELISA, dotbloty a imunoprecipitace. Používají se také k obohacení fragmentovaného vzorku DNA o metylovanou DNA pro následnou analýzu pomocí sekvenování nové generace nebo pomocí hmotnostní spektrometrie, což nám umožňuje získat údaje o stavu metylace vzorků DNA s rozlišením na úrovni báze.
Pro detekci 5-mC, 5-hmC, případně m6A existuje řada komerčně dostupných metylačně specifických protilátek.
Sekvenování nové generace – hydroxymetylační profilování se sníženým zastoupením
Informace o metylaci s rozlišením podle jednotlivých bází na celogenomové úrovni může přinést sekvenování nové generace (NGS). Metoda hydroxymetylačního profilování se sníženým zastoupením (RRHP) se používá k analýze 5-hmC u jednotlivých bází ze vzorků s malým vstupním množstvím bez nutnosti bisulfitové konverze.
Společnost Zymo Research v rámci metody RRHP vyvinula pro přípravu knihoven komplexní kit s následujícím jednoduchým způsobem použití:
- Začínáme štěpením DNA vzorku pomocí Msp1. Msp1 je restrikční enzym, který rozpoznává palindromní sekvenci CCGG a vytváří přesah 5' C.
- Výsledné fragmenty jsou pak ligovány na adaptéry RRHP, které umožňují následné multiplexování a bioinformatickou identifikaci vzorků.
- DNA je poté ošetřena enzymem β-glykosyltransferázou (β-GT), který selektivně glykosyluje místa 5-hmC přítomná v DNA rozštěpené pomocí Msp1.
- DNA se nyní znovu štěpí pomocí Msp1, tentokrát se však štěpí pouze ty fragmenty, které neobsahují glykosylovaný 5-hmC, což znamená, že tento krok z analýzy eliminuje fragmenty DNA postrádající 5-hmC.
- Zbývající fragmenty jsou selektovány z agarózového gelu podle velikosti a nakonec amplifikovány pomocí PCR, čímž se vytvoří finální knihovna RRHP.
- Po sekvenování budou fragmenty s vyššími hladinami 5-hmC korelovat s vyšší frekvencí sekvenačních odečtů.
Metody z oblasti analytické chemie
K analýze metylované DNA se nabízí také řada metod z oblasti analytické chemie, například vysokoúčinná kapalinová chromatografie (HPLC), kapalinová chromatografie s hmotnostní spektrometrií (LC/MS) a chromatografie na tenké vrstvě (TLC).
Při použití těchto metod se analyzovaná DNA nejprve štěpí enzymem, který dokáže DNA rozštěpit na jednotlivé nukleotidy nebo nukleosidy, což v kombinaci s vhodnou následnou metodou umožňuje rozlišení jednotlivých bází. Vyjma TLC vyžadují navazující metody specializované vybavení a odborné znalosti, proto nejsou v mnoha epigenetických výzkumných laboratořích využívány standardně.
(Převzato od společnosti Nordic BioSite, redakčně upraveno.)
V poslední, čtvrté části se zaměříme na metody studia chromatinu a histonů.