Mražení buněk
Udržování zdravých rostoucích buněčných kultur je náročný a složitý úkol, zejména díky riziku jejich ztráty v důsledku nehod nebo kontaminace. Kromě toho aktivně rostoucí buněčné kultury nejsou statické, ale stejně jako všechny populace mikroorganismů podléhají změnám způsobeným stárnutím nebo změnám způsobeným životním prostředím, které mohou mít za následek jejich trvalý vývoj a potenciální ztráty. Tyto problémy se snižují použitím kryogenního uchovávání, při kterém je zastaven biologický čas buněčné kultury. Již v roce 1949 zjistil Polge, Smith a Parkes (11), že glycerol zabraňuje poškození buněk způsobené mrazením. V současné době je k dispozici mnoho postupů mražení buněk, díky kterým je poškození mrazem minimalizováno (3, 6, 13-16).
Výhody mražení buněčných kultur
Jakmile jsou buněčné kultury úspěšně zmraženy a uloženy, vyžaduje jejich údržba jen málo času a úsilí. Jedinou skutečnou cenou jsou náklady na udržení při nízkých teplotách (-130 °C a nižší), mechanická mraznička nebo dodávka kapalného dusíku. Tyto náklady jsou podstatně nižší v porovnáním s náklady na údržbu živých kultur. Zmrazené kultury poskytují důležitý záložní zdroj pro doplňování občasných ztrát způsobených kontaminací nebo nehodami a poskytují záruku homogenní nabídky kultur. Celulární změny nebo alternace se vyskytují ve všech aktivně rostoucích populacích. Tyto změny často vedou ke ztrátě důležitých charakteristik během vývoje kultur, čímž do dlouhodobých experimentů zavádějí nežádoucí proměnné. U kryogenně konzervovaných kultur zjevně nedochází ke změně detekovatelných změn, jakmile budou skladovány pod -130 °C (1, 8). Proto mohou být biologické účinky in vitro buněčného stárnutí a evoluce minimalizovány tím, že se často vracejí do zmrazených kmenových kultur, což umožňuje úspěšné dokončení dlouhodobých kultivačních experimentů bez těchto nežádoucích proměnných.
Co se děje během zmrazování buněk
Abychom pochopili, proč fungují zmrazovací protokoly, je nutno prověřit intracelulární i extracelulární procesy vyskytující se v živočišných buněčných kulturách během procesu mrazení (2, 4, 8). Počáteční chlazení z pokojové teploty na 0 °C zpomaluje buněčný metabolismus, rychle narušuje aktivní transport a iontové pumpy. Obvykle toto narušení nemá za následek poškození buněk, pokud je kultivační médium osmoticky vyvážené. Jak pokračuje chlazení (0 – 20 °C), začnou se vytvářet ledové krystaly v extracelulárním prostředí, které zvyšuje koncentraci rozpouštědla v kultivačním médiu. V důsledku toho se voda začíná pohybovat z buněk do částečně zmrazeného extracelulárního média, přičemž začíná proces buněčné dehydratace a smrštění. Když je proces chlazení rychlý, vzniknou intracelulární ledové krystaly před úplnou dehydratací buněk. Tyto ledové krystaly naruší buněčné organely a membrány a vedou ke smrti buněk během procesu regenerace (rozmrazování) (obr. 2). Když je proces ochlazování pomalý, uvolní se z buněk osmoticky volná intracelulární voda, což vede k úplné dehydrataci a smrštění buněk. I toto může způsobit buněčnou smrt. Fyzické napětí buněčného smršťování může způsobit určité poškození, které vede k nenapravitelné ztrátě membrány a k narušení cytoskeletu a organel. Škody mohou být také způsobeny vysokými koncentracemi rozpuštěných látek ve zbývajícím nezmrazeném extracelulárním médiu (v podstatě solným roztokem). Tyto rozpuštěné látky napadají buňky jak extracelulárně, tak intracelulárně, což vede k poškození membrán, posunu pH a denaturaci proteinů. Avšak pokud je rychlost ochlazování dostatečně pomalá, aby se zabránilo tvorbě intracelulárního ledu, ale dostatečně rychlá, aby se zabránilo vážným dehydratačním účinkům, mohou buňky přežít proces mrazení a rozmrazování. Tato zóna nebo okno pro přežití je snadno pozorovatelná u mnoha bakterií a jiných prokaryot, ale pro většinu eukaryotických buněk buď neexistuje nebo je velmi obtížné jí najít bez použití kryoprotektantů. Tyto látky mají malý vliv na poškození způsobené rychlým zmražením (tvorba intracelulárních krystalů ledu), ale spíše zabraňují nebo snižují poškození způsobené pomalým zmrazením (dehydratací a smršťováním) (8). Pro úspěšnou kryoprezervaci je také důležitá konečná skladovací teplota. Aby došlo k úplnému zastavení biologického času, musí být skladovací teploty udržovány pod -130 °C, teplotou skelného přechodu, pod kterým kapalná voda neexistuje a difúze je nevýznamná. Zatímco mnoho buněčných kultur je úspěšně skladováno při -70 až -90 °C po celé měsíce nebo dokonce roky, biologický čas se nezastaví, zpomaluje se a poškození nebo změny buňky se zvětšují. Uskladnění v tekutém dusíku při -196 °C účinně zabraňuje všem tepelně vyvolaným chemickým reakcím. Při této teplotě působí pouze fotofyzikální účinky způsobené ionizujícím zářením na pozadí. Tyto účinky by však musely působit až tisíce let, aby vyvolaly změny na buněčných kulturách (2, 8).
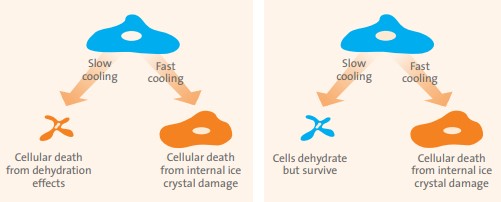
Obrázek 1: Účinky rychlosti zmrazování na buňky (vlevo: bez kryoochrany, vpravo: s kryoochranou)
Praktické aspekty zmrazování buněk
I za nejlepších okolností zůstává proces zmrazování pro všechny buněčné kultury stresujícím. Je důležité, aby bylo možné tyto stresy minimalizovat a maximalizovat buněčné zotavení a přežití. Následující návrhy a doporučení jsou určeny k rozšíření dříve zmíněných protokolů.
1. Výběr buněk
Nejprve se ujistěte, že buňky jsou ve svém nejlepším možném stavu. Vyberte kulturu, která je blízko logaritmické fázi růstu (přibližně 90 % konfluence) a vyměňte jejich médium 24 hodin před sklizní. Pečlivě zkontrolujte, zda kultura nejeví známky mikrobiální kontaminace. Zejména je potřeba se zaměřit na detekci mykoplazmy (pro více informací o detekci mykoplazmy klikněte zde). Zkontrolujte identitu kultur a přítomnost jakýchkoli neočekávaných vlastností (pro informace o autentizaci BK klikněte zde). Sledujte totožnost buněk pomocí karyologické a izoenzymové analýzy, abyste se ujistili, že se jedná o správný druh buněk (10).
2. Odběr buněk
Začněte standardním způsobem sklizně, který se obecně doporučuje pro kultivaci a je co nejjemnější. Odstraňte všechny disociační látky promytím nebo inaktivací (zvláště důležité při použití bez-sérového média). Odstřeďte, pokud je to nezbytně nutné, ale pouze tak, abyste získali měkkou peletu; 100 x g po dobu 5 – 6 minut obvykle postačuje. Aby byla zajištěna stejnorodost konečného zmrazeného materiálu, spojte obsah všech sklizených kultivačních nádob. To také usnadňuje provádění zásadních testů kontroly kvality pro mikrobiální kontaminaci a identitu kultury. Buňky spočítejte a potom zřeďte nebo naopak zakoncentrujte na dvojnásobek konečné požadované koncentrace, která je obvykle 4 až 10 milionů životaschopných buněk na mililitr. Stejný objem média obsahující kryoprotektant při dvojnásobné konečné koncentraci se přidá později, aby se dosáhlo požadovaného inokula. Buňky ochlaďte, aby se zpomalil jejich metabolismus a zabránilo se hromadění buněk. Pokud je to možné, vyhněte se posunu pH do zásadité oblasti pomocí CO2.
3. Kryoochrana
Jak již bylo zmíněno výše, kryoprotektanty jsou nezbytné k minimalizaci nebo prevenci poškození spojeného s pomalým mrazením. Mechanismy poskytující tuto ochranu, i když ještě nejsou zcela pochopeny, se zdají fungovat primárně změnou fyzikálních podmínek jak ledu, tak i roztoků, které bezprostředně obklopují buňky. Permeace buněk kryoprotektanty se nezdá být nezbytnou pro jejich správnou funkci (4). Nezapomeňte, že ochrana proti rychlému poškození mrazem (vnitřní tvorba ledu) není zajištěna těmito látkami, ale spíše opatrným řízením rychlosti mrznutí. Široká škála chemikálií zajišťuje přiměřenou kryoprotekci, včetně methylacetamidu, methylalkoholu, ethylenglykolu a polyvinylpyrrolidonu (7). Dimethylsulfoxid (DMSO) a glycerol jsou však nejvhodnější a široce používané. Mnohé z těchto látek, přestože poskytují vynikající kryoprotekci, mají toxické vedlejší účinky na kulturách, které ztěžují jejich používání. Nejčastěji se používá DMSO v konečné koncentraci 5 až 15 % (obj./obj.). Vždy používejte reagencie s vysokou čistotou, které byly testovány na vhodnost pro dané použití. Sterilizujte filtrací přes 0,2 um nylonovou membránu v pouzdře z polypropylenu nebo nerezové oceli a skladujte v malých množstvích (5 ml). UPOZORŇĚNÍ: buďte zvlášť opatrní, abyste se vyhnuli kontaktu s roztoky obsahující DMSO. Je to velmi silné polární rozpouštědlo schopné rychle proniknout do neporušené pokožky. Jeho nebezpečnost spočívá v tom, že sebou nese škodlivé kontaminující látky, jako jsou karcinogeny nebo toxiny. Některé buněčné linie jsou nepříznivě ovlivněny prodlouženým kontaktem s DMSO. To může být redukováno nebo eliminováno přidáním DMSO k buněčné suspenzi při 4 °C a odstraněním okamžitě po rozmrazení. Pokud toto nepomůže, snižte koncentraci nebo zkuste glycerol nebo jiný kryoprotektant. Glycerol se obecně používá při konečné koncentraci mezi 5 a 20% (v/v). Sterilizujte autoklávováním po dobu 15 minut v malých objemech (5 ml) a ochlazujte ve tmě. Ačkoli je pro buňky méně toxický než DMSO, způsobuje často osmotické problémy, zvláště po rozmrazení. Vždy jej přidejte při pokojové teplotě nebo vyšší a pomalu odstraňte ředěním. Vysoké koncentrace séra také mohou pomoci buňkám přežít zmrazení. Nahrazení standardních směsí kryoprotečních médií s 95% sérem a 5% DMSO může být lepší pro některé více citlivé buněčné linie, zejména hybridomy. Kryoprotektanty přidávejte do kultivačního média (bez buněk) bezprostředně před použitím, aby se dosáhlo dvojnásobku požadované koncentrace (2x). Smíchejte tento roztok s dvojnásobnou koncentrací kryoprotektantu se stejným objemem suspenze buněk (také 2x), aby se získalo inokulum pro zmrazení.
4. Skladovací nádoby
Po zamíchání kryoprotektivního roztoku s buněčnou suspenzí se výsledné inokulum přidá v malých alikvotech (obvykle 1 až 2 ml) do každé skladovací nádoby. Kvůli extrémně nízkým teplotám během kryogenního procesu, nejsou všechny materiály a konstrukce skladovacích nádob vhodné a bezpečné. Mnoho materiálů se při těchto teplotách stává velmi křehkými; nádoby z nich vyrobené se mohou během skladování nebo rozmrazení rozpadnout nebo prasknout. Pečlivě zkontrolujte doporučení výrobce o správném výběru a použití. Důležitý je také výběr těsnícího systému nebo konstrukce uzávěru, které se používají k udržení integrity nádoby, zejména pro skladování v kapalném dusíku. Pokud nádoba během skladování praskne, zaplní se pomalu kapalným dusíkem. Když se nakonec vrátí na pokojovou teplotu, kapalný dusík se rychle odpaří a způsobí tak rychlý nárůst tlaku. Nádoby pak mohou prudce vytlačit víko nebo explodovat. Jedná se o velmi nebezpečnou situaci, zejména pokud nádoby obsahují patogenní organismy nebo potenciálně toxické nebo škodlivé látky. V takových případech se skladování pod tekutým dusíkem nedoporučuje. Pro kryogenní skladování se běžně používají dva typy nádob: tepelně uzavíratelné skleněné ampule a plastové (obvykle polypropylenové) šroubovací vialky. Pro kryogenní skladování jsou výhodnější menší velikosti. Vzhledem k problémům s utěsněním a značením se skleněné ampule již spíše nepoužívají. Široká škála plastových vialek s různobarevnými čepičkami pro snadnější identifikaci a plocha pro označení na vialce přispívají k jejich popularitě. K dispozici je i několik stylů uzávěru – vnitřní a vnější tak, aby se minimalizována kontaminace (viz. obrázek 2).
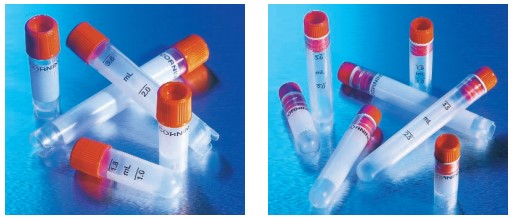
Obrázek 2: Skladovací nádoby s různými styly uzávěrů
5. Označování a vedení záznamů
Zajištění dlouhodobé lokalizace a identifikace zmrazených kultur je nejčastěji přehlíženou oblastí kryogenního skladování. Štítky musí obsahovat dostatek informací k nalezení příslušných záznamů; obvykle postačuje identita kultury, datum zmrazení a iniciály odpovědné osoby. Většina plastových vialek má speciální místa nebo oblasti pro snadné označení. Na vialkách nebo ampulích bez označovacích bodů používejte textilní štítky se speciálními lepidly připravenými pro kryogenní podmínky. Na označování skleněných ampulí jsou k dispozici speciální inkousty na bázi keramiky. Ty se nanáší před naplněním a pak se pečou na sklo, obvykle během sterilizace za sucha. Na skleněné ampule se bílým lakem na nehty může aplikovat trvalé značení. Nezávisle na zvolené metodě označování, věnujte zvláštní pozornost tomu, aby byla zkontrolována její trvalost za kryogenních podmínek. Některá značkovací místa, inkousty a štítky mohou při dlouhodobém skladování vyblednout; doporučuje se zkušební doba nejméně několika týdnů.
6. Rychlost chlazení
Rychlost mrazení buněčných kultur musí být dostatečně pomalá, aby se buňky mohly dehydratovat, ale dostatečně rychlá, aby se zabránilo nadměrnému poškození dehydratací. Rychlost ochlazování od -1 do -3 °C za minutu je uspokojivá pro většinu živočišných buněčných kultur. Větší buňky nebo buňky s méně propustnými membránami mohou vyžadovat pomalejší rychlost mrznutí, protože jejich dehydratace může trvat déle. Nejlepší způsob, jak řídit míru chlazení, je používání elektronických programovatelných mrazicích jednotek. I když jsou drahé, umožňují přesnou kontrolu procesu, poskytují velmi jednotné a reprodukovatelné výsledky a mohou zmrazit velké množství vialek a ampulí. Většina jednotek je k dispozici s mapovými rekordéry pro trvalý záznam procesu chlazení. Existuje řada mechanických mrazicích jednotek, které poskytují adekvátní kontrolu nad rychlostí chlazení a jsou poměrně levné. Některé jednotky používají stojany navržené tak, aby držely vialky v předem stanovených hloubkách v hrdle chladničky s kapalným dusíkem. Rychlost chlazení závisí na celkovém počtu vialek a na hloubce, ve které je regál umístěn. Další konstrukce používá kovovou nebo plastovou nádobu naplněnou alkoholem, která obsahuje stojan s kapacitou až 24 vialek. Naplněná nádoba se umístí do ultracold mechanické mrazničky, kde alkohol působí jako lázeň k dosažení rovnoměrnějšího přenosu tepla a chlazení. Po 4 – 5 hodinách mrazení se lahvičky vyjmou z nádoby a přemístí se do konečného místa skladování.
Izolační lepenkové nebo polystyrenové pěnové boxy se běžně používají jako mrazicí komory v ultracold mrazničkách. Tato homemade zařízení fungují dobře s mnoha buněčnými liniemi, ale ne vždy poskytují řízené, reprodukovatelné nebo jednotné chlazení. V důsledku toho mohou být po rozmrazení závažné rozdíly mezi vialkami. Tento přístup se nedoporučuje pro cenné a nenahraditelné kultury. Bez ohledu na to, jaký způsob chlazení se používá, musí být přenos z chladicí komory nebo zařízení do místa konečného skladování proveden rychle, aby se zabránilo oteplování vialek. Použijte izolační nádobu naplněnou suchým ledem nebo tekutým dusíkem jako přenosovou nádobu, abyste zajistili, že buňky zůstanou pod -70 °C.
7. Kryogenní skladování
Pro dlouhodobé skladování by měly být používány pouze mrazničky schopné udržovat teplotu pod -130 °C. Ačkoli většina mrazniček chlazených kapalným dusíkem a některé speciálně konstruované mechanické mrazničky splňují tento požadavek, většina laboratoří upřednostňuje chladničky s kapalným dusíkem (obr. 3).

Obrázek 3: Mrazničky s kapalným dusíkem
Konečná volba je často založena na dostupnosti spolehlivého zásobování kapalným dusíkem, požadované skladovací kapacitě a velikosti rozpočtu. Mrazničky s kapalným dusíkem umožňují skladování buď v plynné fázi nad kapalinou při teplotě mezi -140 a -180 °C, nebo ponořené do kapaliny při teplotě -196 °C. Skladování v plynné fázi výrazně snižuje možnost prasknutí vialky nebo její exploze během vyjmutí z mrazničky. Skladování v plynné fází však zkracuje dobu skladování (doba, po kterou může být teplota skladování udržována bez přídavku kapalného dusíku). To snižuje bezpečnost mrazničky a vyžaduje častější monitorování a plnění. Při rozhodování o způsobu skladování důkladně zvažte tyto bezpečnostní otázky. Při skladování v plynné fázi v mrazničkách s kapalným dusíkem by měl být stanoven harmonogram kontroly hladiny dusíku a jeho doplňování. Odpařování dusíku je závislé též na míře používání mrazničky. Náhlý, nevysvětlitelný nárůst rychlosti odpařování může signalizovat poškození izolace nebo jiné problémy s mrazničkou a musí být pečlivě prozkoumán. Vyhněte se námraze nebo tvorbě ledu kolem mrazicích otvorů; toto zvyšuje rychlost odpařování dusíku a může způsobit zvýšení teploty v horní části mrazniček s parní fází.
8. Rozmrazování
UPOZORNĚNÍ: Při odstraňování vialek a ampulí z mrazniček s kapalným dusíkem vždy používejte vhodné bezpečnostní vybavení. Pro ochranu proti výbušným ampulím nebo vialkám se důrazně doporučuje celoobličejový štít, těžké rukavice a laboratorní plášť. Vyjměte vialku nebo ampulku z místa jejích uložení a pečlivě zkontrolujte jak štítek, tak i záznam o skladování, abyste se ujistili, že jde o správnou kulturu. Umístěte nádobu do teplé vody, opatrně s ní kružte, než se zcela rozmrazí. Rychlé rozmrazení (60 až 90 sekund při 37 °C) poskytuje nejlepší obnovu pro většinu buněčných kultur; snižuje nebo zabraňuje tvorbě poškozených ledových krystalů v buňkách během rehydratace.
9. Zotavení
Vzhledem k tomu, že některé kryoprotektní látky mohou při dlouhodobé expozici buňky poškodit, odstraňte činidla co možná nejrychleji a nejjemněji. Používá se několik přístupů v závislosti na kryoprotektivních činidlech a charakteristikách buněk. Většina buněk se obnoví normálně, pokud mají kryoprotektní látku odstraněnou změnou media během 6 až 8 hodin rozmrazování. Obsah vialky nebo lahvičky přeneste do baňky T-75 nebo do jiné vhodné nádoby obsahující 15 až 20 mililitrů kultivačního média a inkubujte běžným způsobem. Jakmile je většina buněk adherována, odstraňte médium obsahující nyní zředěné kryoprotektivní činidlo a vyměňte za čerstvé médium. Pro buňky, které jsou citlivé na kryoprotektanty, lze odstranění starého média snadno provést jemným odstředěním. Obsah ampule nebo vialky přeneste do 15 ml centrifugační zkumavky obsahující 10 ml čerstvého média a odstřeďte 5 minut při 100 x g. Ostraňte supernatant obsahující kryoprotektant a resuspendujte buněčnou peletu v čerstvém médiu. Potom buněčnou suspenzi přeneste do vhodné kultivační nádoby a inkubujte běžným způsobem. Když se jako kryoprotektant používá glycerol, náhlý přísun velkého objemu čerstvého média do roztavené buněčné suspenze může způsobit osmotický šok, poškození nebo zničení buněk. Před dalším zpracováním použijte několik krokových ředění s rovnoměrným objemem teplého média každých 10 minut, aby buňky měly čas upravit svou osmotickou rovnováhu.
10. Řešení problémů
Problémy životaschopnosti spojené s kryogenním skladováním jsou obvykle brzy zaznamenány poté, co byly kultury rozmraženy. Existují čtyři hlavní oblasti, kde se vyskytují problémy:
a) Během sklizně a zpracování buněk
Problémy mohou být způsobeny nadměrným vystavením buněk disociačním činidlům; s použitím kryoprotektantu, který je toxický; nebo umožnění, aby suspenze buněk s vysokou hustotou zůstaly příliš dlouho při pokojové teplotě nebo při příliš zásaditém pH.
b) Během procesu chlazení (zmrazování)
Nadměrné poškození buněk a snížená životaschopnost kultury jsou často výsledkem použití rychlosti chlazení, která je příliš rychlá nebo příliš pomalá, nebo když je proces chlazení dočasně přerušený. Použití nevhodného kryoprotektivního činidla o nevhodné koncentraci bude mít také za následek problémy s životaschopností.
c) Během kryogenního skladování
Životaschopnost kultury je často snížena, když se mohou lahvičky během přechodu do mrazničky zahřát nebo pokud teplota úložiště není udržována v odpovídajících kryogenních teplotách.
d) Při rozmrazování a zotavení
Problémy vznikají, když je proces rozmrazování příliš pomalý nebo jsou kryoprotektanty odstraněny nesprávně (viz výše).
Tyto problémy s životaschopností mohou být často opraveny pomocí následující techniky k identifikaci fáze procesu zmrazení, kde vzniká problém. Skliďte dostatečný počet buněk pro přípravu nejméně čtyř lahviček. Potom odeberte vzorek buněčné suspenze, ekvivalentní k počtu buněk, který bude vložen do ampulek, a okamžitě vložte do kultivační nádoby s vhodným množstvím média a inkubujte. Tato kultura bude použita jako kontrola k porovnání s kulturami nastavenými v ostatních krocích. Dále přidejte kryoprotektant ke zbývajícím buňkám a rozdělte je mezi tři vialky. Jednu vialku umístěte na jednu hodinu do chladničky o teplotě 4 °C. Potom vyjměte buňky z vialky, zpracujte je, jako by byly právě rozmrazeny, a vložte do nich médium, jak je uvedeno výše. Tato kultura bude porovnávána s kontrolní kulturou, aby se zjistilo, zda jsou nějaké problémy spojené s kryoprotektním činidlem. Mezitím zpracujte zbývající vialky procesem pomalého chlazení obvyklým způsobem. Jedna vialka se okamžitě rozmrazí a zpracuje, jak je uvedeno výše. Tato kultura bude porovnána s kontrolní kulturou, aby se zjistilo, zda existují nějaké problémy spojené s procesem pomalého chlazení. Zbývající vialka se potom přenese do kryogenní mrazničky a skladuje se přes noc před roztátím a zpracováním, jak je uvedeno výše. Tato kultura bude porovnána s kontrolní kulturou, aby se zjistilo, zda existují nějaké problémy spojené s podmínkami kryogenního skladování. Pokud jsou k dispozici další vialky s buňkami, mělo by se použít několik různých způsobů obnovy, aby se zjistilo, zda je technika obnovy zdrojem problému. Srovnáním všech kultur s původní kulturou by mělo být možné určit, ve které fázi procesu mrazení nastaly potíže. Jakmile to bude známo, informace uvedené v tomto návodu by měly stačit k odstranění problému.
Seznam úkolů při mrazení
- Jemně skliďte kultury
- Zkontrolujte kontaminaci kultur, zejména mykoplazmou
- Zkontrolujte identitu analýzou karyotypů a izoenzymů
- Používejte testované kryoprotektanty
- Používejte pouze lahvičky testované na kryogenní podmínky
- Zajistěte, aby štítky byly trvalé a kompletní
- Ovládejte rychlost chlazení
- Kulturu uchovávejte pod -130 °C
- Monitorujte hladinu dusíku
- Udržujte dobré záznamy
11. Správa buněčného úložiště
Kultury, které lze snadno nahradit jinými laboratořemi nebo komerčními zdroji, nemusí vyžadovat zvláštní úsilí, ale jedinečné kultury, jako jsou hybridomy a jiné geneticky modifikované buňky jsou nenahraditelné a vyžadují zvláštní úsilí k zajištění jejich bezpečnosti. Odpovědi na tyto otázky pomohou určit, jak velké a důkladné by mělo být vaše úsilí. Dále identifikujte potenciální problémové oblasti, které mohou způsobit ztrátu těchto kultur. Některé z těchto oblastí, jako je výběr nádob, vedení záznamů, označování, monitorování mrazničky, podmínky skladování a otázky kvality (kontaminace a identita druhů), byly popsány. Určete, jaké kroky jsou nezbytné k odstranění nebo minimalizaci těchto problémů. Rozdělte nezastupitelné nebo extrémně cenné kultury do několika mrazniček. Jeden poslední krok zůstává; Připravte si záložní plán dříve, než nastane selhání mrazničky nebo jiná komplikace! Jednou z nejzávažnějších a nečekaných mimořádných událostí je selhání mrazničky. Pečlivé sledování hladiny tekutého dusíku nebo zaznamenávání teploty může včas upozornit na to, že došlo k selhání, avšak může dojít k nočním selháním, a i na to je třeba se připravit dopředu.
(Převzato ze zahraničního zdroje, redakčně upraveno.)
Vybrali jsme pro Vás nejlepší produkty pro mražení buněk!
- Mrazící kontejnery
- Vialky
- DMSO
Mrazicí kontejnery
- kontrolované snižování teploty o 1°C/minutu při umístění do -80 °C
- šetrnější a levnější řešení – bez nutnosti použití isopropanolu (isopropanolové (IPA)) kontejnery vyžadují cenově nákladné doplnění alkoholu cca každé 5. použití
- aplikace na řadu typů buněk, zahrnujících kmenové buňky, primární buňky, PBMC buněčné linie, hmyzí buňky a kvasinky.
Princip
Technologie CoolCell využívá tepelně vodivé jádro slitiny a vysoce izolační vnější materiál pro řízení rychlosti odvodu tepla a zajišťuje tak reprodukovatelnou kryoprezervaci buněk.
Jak funguje Corning CoolCell LX?
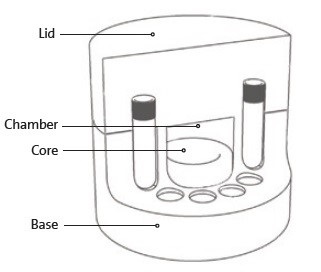
Corning CoolCell LX používá kombinaci polyethylenové pěny s rovnoměrnou hustotou, pevného jádra a radiální symetrie vialky pro vytvoření mrazících profilů, které jsou konzistentní a reprodukovatelné. Nádoby CoolCell LX se také po vyjmutí z mrazničky rychle vrátí na pokojovou teplotu.
Corning® CoolCell® výhody
- jednoduchost použití
- bez alkoholu a mrazicích kapalin
- levnější než zařízení založená na alkoholu
- vysoká regenerace a životaschopnost buněk
- opakovatelnost
- jednoduchá, konzistentní cesta ke standardizaci kontrolované rychlosti mrazení
| Produkt | Kat. č. | Počet vialek | |
 |
432001 | 12 x 2 ml | koupit |
 |
432002 | 12 x 2 ml | koupit |
 |
432003 | 12 x 2 ml | koupit |
 |
432004 | 12 x 2 ml | koupit |
 |
432006 | 30 x 2 ml | koupit |
 |
432007 | 30 x 2 ml | koupit |
 |
432008 | 30 x 2 ml | koupit |
 |
432009 | 30 x 2 ml | koupit |
Vialky
Vyrobené z polypropylenu, odolné vůči teplotám do -196 °C. Černá graduace s velkou značící plochou.
Vialky mají silikonové těsnění pro lepší nepropustnost. Možnost barevných inzertů k rozlišení vialek.
Samostatně stojící (self standing) vialky mají speciální základnu, která umožňuje i jejich uzamčení do kryogenního stojanu a zásobníku (kat.č. 431131) pro manipulaci jednou rukou.
S každým balíkem pěnový zásobník zdarma.
Vlastnosti:
- RNase-/DNase-free
- Sterilní
- Nepyrogenní
Variany produktů:
- 1,2 nebo 2 ml
- externí nebo interní uzávěr
- kulaté nebo kónické dno
- celkem 500 ks, vbaleních po 50 ks
| Kat. č. | Produkt | |
| 430658 | Cryo Vial, 1,2ml, polypropylen, SelfStanding, Externí uzávěr, kónické dno, sterilní, celkem 500 ks, v baleních po 50 ks | koupit |
| 430487 | CryoVial, 1,2mL, polypropylen, SelfStanding, Interní uzávěr, kónické dno, sterilní, celkem 500 ks, v baleních po 50 ks | koupit |
| 430488 | CryoVial, 2mL, polypropylen, SelfStanding, Interní uzávěr, kulaté dno, sterilní, celkem 500 ks, v baleních po 50 ks | koupit |
| 430659 | CryoVial, 2mL, polypropylen, SelfStanding, Externí uzávěr, kulaté dno, sterilní, celkem 500 ks, v baleních po 50 ks | koupit |
DMSO
Kryoprezervační činidlo, které brání poškození buněčné membrány během zmrazení.
Vybrat si můžete z našich dvou dodavatelů:
- Arbor Assay - DRY DMSO
- PAN Biotech - DMSO / DMSO for cell culture