Vítejte u čtvrtého a zároveň posledního dílu našeho rychlokurzu epigenetiky!
Dosud jsme si představili obor epigenetiky a zabývali jsme se bisulfitovými i ostatními přístupy ke studiu metylace nukleových kyselin. V této poslední části se zaměříme na metody studia chromatinu a histonů.
Proč se zabývat studiem histonů a chromatinu?
Zatímco studium metylace nukleových kyselin nám může prozradit hodně o tom, jak se zapínají a vypínají jednotlivé geny a transkripty, studium histonů a chromatinu nám může pomoci komplexněji pochopit následující děje:
- Jak DNA interaguje se strukturálními proteiny a enzymy zapojenými do epigenetických procesů
- Jak tyto interakce regulují a ovlivňují zásadní procesy, jako je například embryonální vývoj
- Jak mohou aberantní procesy vést k neurologickým poruchám, karcinomům a dalším onemocněním
Možná si z první části vybavíte, že chromatin se skládá z chromozomální DNA velice pevně sbalené do struktur podobných korálkům a upevněných histony, kterým se říká nukleozomy. Pevně sbalený chromatin se nazývá heterochromatin, zatímco volně sbalený chromatin, který je přístupný pro transkripční mechanismus, se nazývá euchromatin.
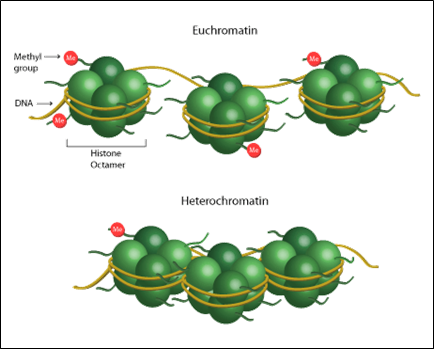
Obr. 1: Ilustrace volně sbaleného euchromatinu a pevně sbaleného heterochromatinu.
Obrázek použit se svolením společnosti Epigentek.
Geny s heterochromatickými oblastmi nelze transkribovat, protože nejsou pro transkripční mechanismus přístupné, a tak se jeví jako tiché. Naopak geny s euchromatinem lze transkribovat snadno.
Sbalování a rozbalování chromatinu je zprostředkováno enzymy, které modifikují strukturu chromatinu, ať už přímo (chromatin modifikující enzymy), nebo nepřímo ovlivňováním funkce histonů (histon modifikující enzymy).
Jak se histony a chromatin studují?
Ke zkoumání funkce a vlivu histon a chromatin modifikujících enzymů se využívají různé přístupy jako například:
Testy:
- Mikrotitrační destičkové testy, pomocí nichž lze měřit aktivitu modifikujících enzymů nebo samotných modifikací, např. modifikací histonů z kvantitativního hlediska.
Metody na bázi protilátek:
- imunoprecipitace
- imunohistochemie (IHC)
- imunofluorescence (IF)
Analýza modifikace histonů
Dosud bylo identifikováno pět různých typů histonů, které spadají do dvou kategorií: hlavní histony H2A, H2B, H3 a H4, spojovací histon H1 a jeho homolog H5. Hlavní histony se spojují s DNA a vytvářejí nukleozomy, zatímco spojovací histony zprostředkovávají vznik chromatinových struktur vyššího řádu.
Posttranslační modifikace histonů, obvykle na jejich N-terminálních koncích, ovlivňují změnou struktury chromatinu expresi genů / celých oblastí. Tento proces probíhá přímo nebo aktivizací dalších enzymů, které jsou schopny remodelovat chromatin pro přechod mezi heterochromatickým a euchromatickým stavem.
Mezi hlavní histonové modifikace patří metylace, fosforylace, acetylace a ubikvitinylace. Histony jsou obvykle modifikovány na specifických reziduích aminokyselin při značné konzervaci v rámci jednotlivých druhů (obr. 2).
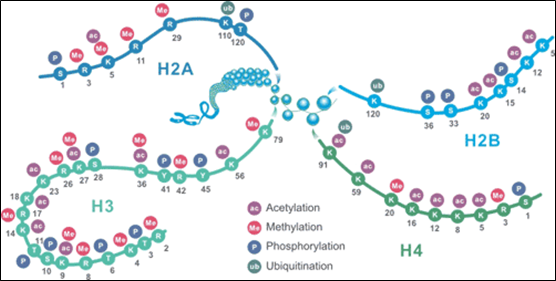
Obr. 2: Schéma hlavních histonových posttranslačních modifikací. U většiny druhů je histon H3 primárně acetylován na lyzinech 9, 14, 18, 23 a 56, metylován na argininu 2 a lyzinech 4, 9, 27, 36 a 79 a fosforylován na ser10, ser28, Thr3 a Thr11. Histon H4 je primárně acetylován na lyzinech 5, 8, 12 a 16, metylován na argininu 3 a lyzinu 20 a fosforylován na serinu 1. Obrázek použit se svolením společnosti Cusabio.
Mezi nejčastěji zkoumané histon modifikující enzymy patří histon acetyltransferázy (HAT), histon deacetylázy (HDAC), histon metyltransferázy (HMT) a histon demetylázy. Ty přidávají, respektive odebírají acetylové a metylové skupiny u histonů na specifických reziduích aminokyselin.
Aktivitu těchto enzymů lze sledovat nepřímo pomocí testů typu ELISA, které za použití vysoce specifických protilátek detekují přítomnost odpovídajících histonových značek, nebo přímo pomocí testů enzymatické aktivity, které jsou navrženy tak, aby kvantitativně zjistily schopnost specifického enzymu (přítomného ve zkoumaném vzorku) modifikovat histonový substrát dodaný s testem.
Společnost Nordic BioSite nabízí ke studiu hlavních histonových modifikací a aktivity histon modifikujících enzymů celou řadu kitů od výrobce Epigentek. Vybrané výrobky z této nabídky zahrnují kity pro studium individuální metylace a demetylace histonů a kity pro studium individuální acetylace a deacetylace histonů. Dále jsou v nabídce dva multiplexní screeningové kity, které umožňují současně detekovat a kvantifikovat 21 různých modifikací H3 nebo 10 různých modifikací H4 v jediném vzorku.
Společnost Nordic BioSite také nabízí rozsáhlý výběr protilátek od mnoha dodavatelů, které lze použít k detekci jednotlivých modifikací histonů i jejich kombinací, a to například v testech Western blot, v imunoprecipitaci a dále v mikroskopických metodách, jako je imunohistochemie (IHC) a imunofluorescence (IF).
Analýza chromatinu pomocí imunoprecipitace
Převládající metodou zkoumání interakcí mezi proteiny a DNA je chromatinová imunoprecipitace (ChIP). Jde o obohacovací metodu prováděnou pomocí vysoce specifické protilátky, která se dokáže navázat na cílový protein vázající DNA v rámci chromatinového extraktu nebo buněčného lyzátu. Před ChIP je analyzovaný chromatin fragmentován štěpením nebo stříháním na bázi sonikace podle toho, zda buněčné lýze předcházela fixace pro síťování proteinů a chromatinu.
Jakmile se zachytávací protilátka naváže na cílový protein a všechny sekvence DNA, s nimiž je ve vzájemné interakci, cílový protein je ze zbytku vzorku následně vysrážen. V tomto bodě se obvykle provádí čištění vázané DNA, aby se odstranila veškerá činidla a materiály, které by mohly v dalším procesu působit rušivě.
Výsledný obohacený vzorek lze pak použít v řadě následných aplikací, včetně PCR, bisulfitové konverze, „microarray“ analýzy nebo sekvenování nové generace (NGS), ke stanovení, které oblasti gDNA byly cílovou metylací modifikovány.
Pomocí ChIP je možné studovat konkrétní interakci mezi proteiny a DNA, několik interakcí mezi proteiny a DNA nebo způsoby interakce napříč celým genomem nebo podskupinou genů. V experimentu ChIP může být použita zachytávací protilátka, která váže histony, modifikace histonů, transkripční faktory nebo kofaktory. Takto lze získat informace o stavu chromatinu a transkripci genů.
Následující části se zaměřují na některé z nejoblíbenějších pracovních postupů analýzy chromatinu na bázi ChIP.
ChIP-Seq
Jak název napovídá, ChIP-Seq je pracovní postup kombinující ChIP a NGS. ChIP-Seq je preferovaná metoda pro identifikaci celogenomových vazebných míst DNA transkripčních faktorů a dalších DNA vázajících proteinů.
ChIP-Seq generuje velké datové soubory a nabízí výhodu řešení specifické genetické sekvence cílových vazebných míst proteinů, jež lze mapovat na celogenomové úrovni.
ChIP-PCR
V tomto pracovním postupu se kvantitativní real-time PCR (RT-qPCR) kombinuje s ChIP za účelem analýzy vazebných míst DNA u vybraných histonů, případně jiných proteinů vázajících DNA, které jsou předmětem našeho zájmu.
ChIP-PCR je dobrou volbou, má-li výzkumný pracovník na mysli konkrétní soubor cílových lokusů a chce zjistit, zda s danými loky cílový protein interaguje. V takovém případě si výzkumný pracovník vytvoří sadu primerů přímo pro konkrétní cílové loky a použije je k amplifikaci cílových lokusů ze vzorků obohacených ChIP v rámci real-time PCR.
Pro účely provádění rychlých, citlivých a specifických ChIP-PCR nabízí společnost Epigentek EpiQuik™ Quantitative PCR Fast Kit, který využívá inovovanou polymerázu s horkým startem („hot start“), díky čemuž je celková doba testu zkrácena na 70 minut.
CUT&RUN a CUT&TAG
CUT&RUN je nedávno vyvinutá metoda studia interakcí mezi DNA a proteiny. Název znamená štěpení pod cíli a uvolňování pomocí nukleázy (Cleavage Under Target & Release Using Nuclease), přičemž tento postup byl vytvořen, aby zlepšil konvenční ChIP použitou k uvolnění zachycených komplexů cílových proteinů a DNA z omezených biologických materiálů pro účely mapování interakcí mezi proteiny a DNA.
V rámci CUT&RUN jsou jádra izolována z buněk a komplex cílových proteinů a DNA je vázán předmětnou protilátkou o požadované čistotě („ChIP-grade“) stejně jako ve standardní ChIP. Následně je chromatin fragmentován aplikací jedinečné kombinace enzymů štěpících nukleové kyseliny. Tím jsou rozštěpeny a odstraněny sekvence DNA na obou koncích cílového komplexu proteinů a DNA, aniž by byla narušena sekvence DNA vázaná cílovým proteinem. DNA vázaná cílovým proteinem se pak čistí a vymývá, načež je obohacenou DNA možno dále analyzovat pomocí ChIP-Seq, ChIP-PCR či jiné následné aplikace.
Odstranění sekvencí DNA sousedících s cílovým vazebným místem umožňuje provádět ChIP s mnohem menším množstvím výchozího materiálu a také to výrazně snižuje signály pozadí v následných testech.
CUT&RUN je možno dále rozšířit prostřednictvím postupu cTIP (CUT & Tag In Place), a připravit tak knihovnu pro sekvenování nové generace. Protokol CUT&RUN společnosti Epigentek následovaný protokolem CUT&TAG pro přípravu knihovny nabízí podobné řešení jako ChIP-Seq a zároveň zachovává výše uvedené výhody CUT&RUN (obr. 3).
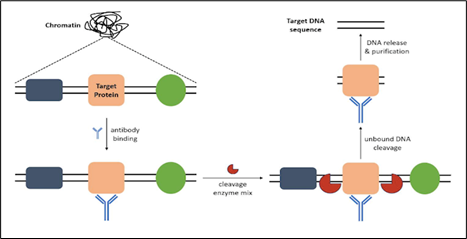
Obr. 3: Schématické znázornění pracovního postupu CUT&RUN. Obrázek použit se svolením společnosti Epigentek.
(Převzato od společnosti Nordic BioSite, redakčně upraveno.)