Nový balíček vědeckých nástrojů. Proč je tak důležitý a jak jej můžete použít?
Termín fotomanipulace popisuje širokou škálu technik, které umožňují člověku obsluhujícímu mikroskop přejít z pasivního pozorovatele na hybatele událostí tím, že nabízejí způsob interakce se zkoumaným vzorkem prostřednictvím jeho cíleného osvětlení.
Vědci se obvykle snaží pozorovat konkrétní procesy, které je zajímají, aby pochopili základní biologický proces. Mikroskopisté jsou často nuceni procházet velkou populaci buněk nebo získávat hodiny dlouhé stopáže, než jsou schopni pozorovat události, které je zajímají. A v mnoha případech prostě není možné pozorovat určité procesy pouze pomocí konvenčních mikroskopických technik.
Nástroje fotomanipulace umožňují mikroskopistovi iniciovat biologické jevy, přesně nastavit označení vzorků, biologickou aktivitu, místní chemické prostředí a v některých případech i fyzicky zničit části vzorků. Tyto vlastnosti jsou nesmírně cenné, když dojde na řešení komplexních a oddělených biologických mechanismů. Nástroje fotomanipulace umožňují uživatelům navrhnout pokročilé experimenty, které umožní přístup k dalším vrstvám informací ze vzorku, které nelze získat pouhým pozorováním.
Fotobělení a ta další slova na F
Fotobělení je fotochemický proces, při kterém silná excitace fluoroforu trvale znemožňuje fluorescenci. Protein, ke kterému je fluorofor připojen, zůstává biologicky aktivní, což umožňuje uživatelům generovat 2 odlišné populace proteinu (fluorescenční / nefluorescenční).
Slova na F popisují řadu technik, které zahrnují odbarvení fluoroforu pomocí krátkého záblesku zacíleného osvětlení a následného zaznamenání jeho přerozdělení ve zbývající označené populaci. Tyto techniky umožňují uživatelům kvantitativně studovat kompartmentalizaci a fluktuaci značeného proteinu v subcelulárních strukturách.
Obnova fluorescence po fotobělení (FRAP) zahrnuje odbarvování některých značených částí a záznam obnovy fluorescenčního signálu v cílové oblasti migrací neběleného proteinu do bělených zón (obr. 1). Vykreslování křivek obnovy umožňuje uživatelům kvantifikovat rychlosti obnovy signálu a rozlišovat mezi jednofázovými a vícefázovými profily obnovy. Tato technika umožňuje uživateli prozkoumat přesuny a kompartmentalizaci zkoumaných struktur.
Klasické fluorescenční značení fluorescenčními proteiny pouze umožňuje sledovat, kde se protein nachází; neumožňuje nahlédnout do zdánlivě pevně značených objektů (vezikul / vlákno), a pochopit tak, jak se molekuly pohybují a mění uvnitř struktury. Kromě toho se vnitřní dynamika objektů může lišit v různých oblastech buňky nebo v reakci na vnější podněty, jako jsou cytokiny nebo patogeny. Stručně řečeno, FRAP je stále velmi užitečná technika, kterou lze použít ke studiu plasticity a přeměn a vzájemného propojení struktur v buňkách (viz obr. 2).
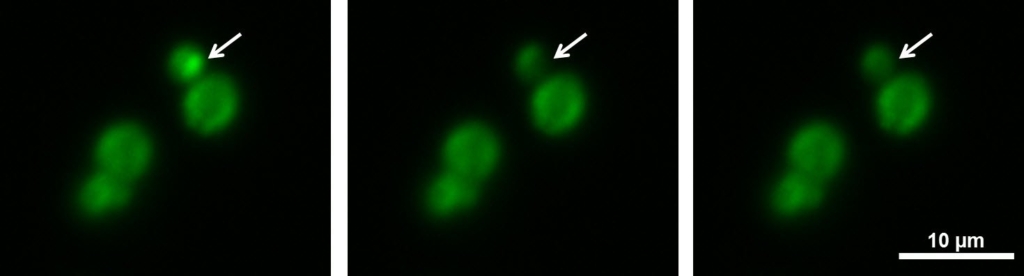
Obrázek 1: Experiment FRAP v kvasinkových buňkách. P-bodies těchto kvasinkových buněk nesou fluorescenčně značený protein. V průběhu experimentu FRAP lze vybělit malou strukturu a pozorovat obnovu (šipka).
Ztráta fluorescence fotobělením (FLIP) je další bělící technika, kterou lze považovat za reverzní FRAP. Cílová oblast je bělena opakovaně v průběhu času a vyfocena po každém bělícím cyklu. Na rozdíl od metody FRAP, která hledá obnovení fluorescence v cílové oblasti, FLIP sleduje pravidelnou ztrátu signálu ve zbytku buňky. Tato technika odhaluje mobilitu molekul v celé buňce a umožňuje uživateli identifikovat oblasti s vysokým a nízkým obratem ve více buněčných kompartmentech. Tuto techniku lze použít k pozorování složitých drah přeměny proteinu, jako je cytokeratin, které by jinak nemusely být zjevné. Zatímco FRAP umožňuje studovat cyklus přeměny v určité oblasti, FLIP vám umožňuje sledovat cyklus a rozložení molekuly v celé buňce.
Försterův přenos rezonanční energie (FRET), známý také jako přenos fluorescenční rezonanční energie, je proces, při kterém se energie přenáší z jednoho fluoroforu do druhého a lze ji využít k měření mezimolekulárních a intramolekulárních vzdáleností. FRET se vyskytuje pouze na extrémně malých vzdálenostech (obvykle 1–10 nm), a lze jej tedy použít ke kvantifikaci a mapování vazebných a proteinových interakcí uvnitř buněk.
Po excitaci donorový fluorofor přenáší energii na akceptorový fluorofor, který obvykle emituje záření o delší vlnové délce než donor. Účinnost FRET se obvykle měří pomocí poměrového zobrazování nebo prostřednictvím změn v zobrazování životnosti fluorescence donoru (FLIM – fluorescence-lifetime imaging microscopy). Když dojde k jevu FRET, emise donoru se utlumí a akceptorový emisní kanál se zvýší. Při fotobělení akceptoru FRET je akceptor bělený v cílové oblasti, takže jev FRET tam již nemůže nastat, což zruší potlačení emise záření donoru. Zvýšení signálu donoru (od-zhášeného) lze použít k přímému měření účinnosti FRET.
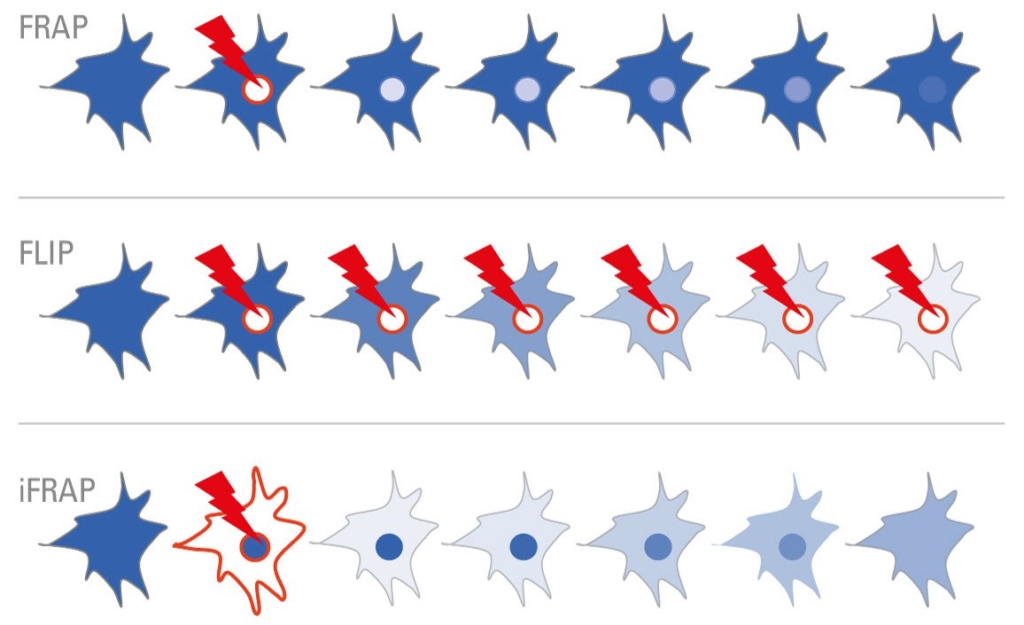
Obrázek 2: Během obnovy fluorescence po fotobělení (FRAP) je fluorescenční značka proteinu bělena silnou excitací uvnitř cílové oblasti (ROI – region of interest). Následné přesuny poskytují vhled např. do mobility zkoumané struktury. Pro ztrátu fluorescence fotobělením (FLIP) se ROI v buňce opakovaně bělí. Vybělené molekuly se rozšiřují a ztráta fluorescence naznačuje, zda jsou např. buněčné organely fyzicky propojeny. Během inverzního FRAP (iFRAP) je vybělena oblast buněk mimo ROI. Následně se nebělené molekuly šíří a mohou být monitorovány.
Fotochromismus
Kromě ničení fluorescenčních vlastností barviv pomocí fotobělení lze fotomanipulaci použít také k aktivaci mnoha fotocitlivých fluorescenčních proteinů. Mnoho druhů fluoroforů má schopnost přepínat mezi různými molekulárními stavy při ozáření specifickými vlnovými délkami, což je vlastnost známá jako fotochromismus. Fotochromismus umožňuje fluoroforům přepínat mezi nízkým a vysokým fluorescenčním stavem (fotoaktivace) nebo měnit jejich emisní spektra při stimulaci (fotokonverze) (s. Obrázek 3).
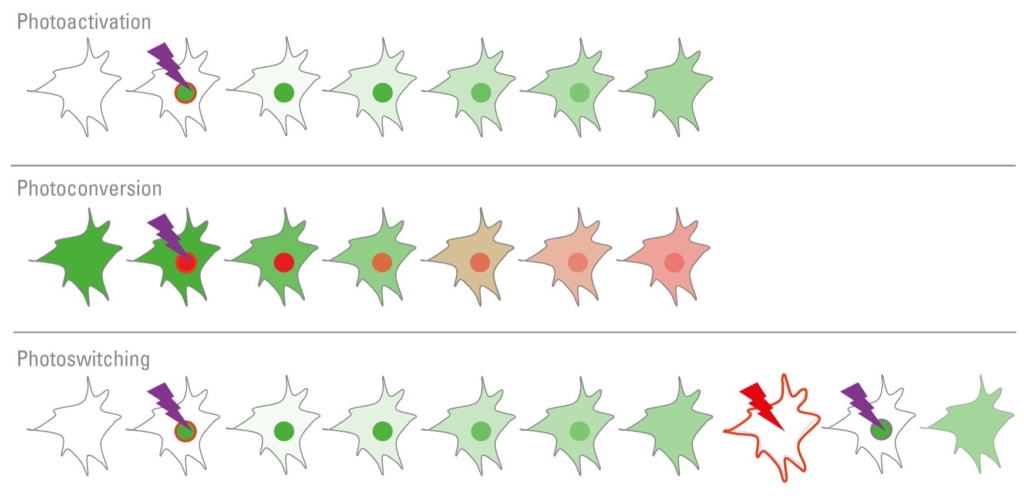
Obrázek 3: Fotoaktivaci, fotokonverzi a fotopřepínání lze použít ke sledování populací proteinů v průběhu času. Fotoaktivovatelné proteiny lze „zapnout“ světlem určité vlnové délky. Fotokonvertovatelné proteiny mohou měnit své emisní spektrum, zatímco fotopřepínatelné proteiny lze mnohokrát zapnout a vypnout.
Dobře známým příkladem fotokonverze je mEOS, který po aktivaci při 405 nm vykazuje přechod ze zelené barvy na červenou, čímž posunuje svůj emisní pík z 516 nm na 581 nm. Fotoaktivovatelné proteiny umožňují uživatelům sledovat dvě odlišné populace (aktivované / neaktivované) jednoho proteinu, zatímco fotokonvertovatelné proteiny mohou být užitečné, když se snažíte pozorovat vícečetně značené proteiny. Fotopřepínatelné fluorescenční proteiny vykazují reverzibilní fotochromismus a jsou schopné se opakovaně obnovovat mezi různými stavy, což uživatelům umožňuje jejich zapnutí a vypnutí (například Dronpa).
Primárním použitím fotochromismu při použití s fotomanipulacemi je sledování populací aktivovaných proteinů v průběhu času.
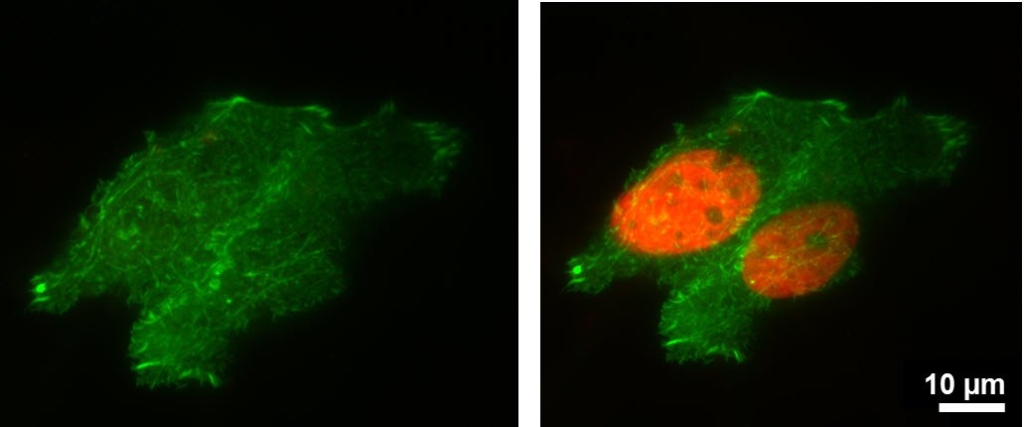
Obrázek 4: Pro tento fotoaktivační experiment byly buňky HeLa transfekovány pomocí pamCherry-H2B a eGFP-aktinem. Po fotoaktivaci vykazuje pamCherry jasnou fluorescenci.
Stojí za zmínku, že fluorofory vykazující fotochromismus lze také použít pro super-rozlišovací techniky lokalizace jedné molekuly, jako například v sptPALM a fPALM. Když je jednou fúzní protein vytvořen, lze jej často použít pro více doplňkových technik.
Fotochromní proteiny jsou zvláště užitečné, když se snažíte pozorovat chování hojně exprimovaných proteinů. Například fotoaktivovatelné fluorofory umožňují uživatelům snadno sledovat konkrétní objekty v jinak přeplněných prostředích. Tento přístup může být užitečný, když se pokoušíte sledovat jednotlivé objekty a používáte dlouhé časosběrné intervaly pro snížení stresu z ozařování.
Fotoaktivní fluorofory také umožňují uživatelům vizualizovat difúzi mezi jednotlivými buněčnými oddíly nebo zkoumat plasticitu a mobilitu uvnitř zdánlivě pevných struktur, jako jsou vlákna cytoskeletu. Tato technika umožňuje uživatelům sledovat, zda dochází k výměně podjednotek mezi sousedními objekty. Tato technika dále umožňuje uživatelům studovat linii objektů od fúze a štěpení vezikul až po umístění a identitu dceřiných buněk.
Fotochromní proteiny lze také použít pro “pulse-chase” experimenty, kdy jsou všechny proteiny v buňce konvertovány, což umožňuje uživatelům rozlišovat mezi proteiny vytvořenými před a po fotomanipulační události. A konečně, některé fotopřepínatelné proteiny lze také použít jako optogenetické akční členy, přičemž kromě změny fluorescenčních vlastností barviva se také používá konformační změna k přepnutí aktivit ostatních konjugovaných biomolekul.
Je důležité pečlivě zvážit vaše potřeby a vybrat ten správný fluorescenční protein (FP) odpovídající vašim požadavkům. Některé fotoaktivovatelné FP jsou výrazně jasnější než jiné. Například paGFP vykazuje při aktivaci cca 100 násobné zvýšení jasu, zatímco některé proteiny jako Kaede vykazují 2 000 násobné zvýšení jasu [13]. Jasnější FP umožňují uživatelům sledovat malé množství proteinů nebo dosáhnout srovnatelné úrovně signálu a šumu s mnohem nižším nastavením excitace, čímž se minimalizuje fototoxicita. Za zmínku stojí také to, že s fotokonvertibilními proteiny se pracuje snáze než s fotoaktivovatelnými proteiny, které jsou přirozeně viditelné před aktivací. A naopak vyžadují použití dvou zobrazovacích kanálů pro jednu populaci proteinů, takže uživatelům, kteří plánují zobrazovat více proteinů v jednom experimentu, se bude lépe pracovat s fotoaktivovatelnými proteiny.
Optogenetika
Kromě kontroly vlastností fluorescenčních značek je také možné použít fotomanipulaci k selektivní aktivaci biologických cest použitím fotocitlivých proteinových domén pomocí procesu, který se běžně označuje jako optogenetika. Nástroje optogenetiky umožňují uživatelům vysoce cíleně stimulovat buňky na povel. Klasická optogenetika využívá cílenou aktivaci fotocitlivých iontových kanálů ke změně potenciálu membránového napětí.
Nejznámější optogenetické efektory patří do rodiny rhodopsinů. Rhodopsiny jsou nespecifické kationtové kanály, nicméně už byly objeveny nebo vytvořeny i anionty přenášející rhodopsiny a iontově specifické kanály. Následný účinek aktivace lze měřit elektrofyziologicky nebo pomocí optických senzorů, jako jsou ratiometrické vápníkové indikátory (ratiometric calcium dyes). Fotosenzitivní iontové kanály jsou nesmírně cenným nástrojem, protože umožňují stimulaci neuronů a jiných typů buněk s vysokým prostorovým a časovým rozlišením. Také stojí za zmínku, že je také možné optické řízení signalizace zprostředkované G proteinem.
Kromě klasických optogenetických regulátorů založených na receptorech vzniká celá sada optogenetických nástrojů v návaznosti na objevy a dostupnost mnoha dalších fotosenzitivních domén. Fotosenzitivní domény, jako jsou “light, oxygen and voltage sensing” (LOV), fytochromy nebo kryptochromy z rostlin, lze zkonstruovat na efektorové proteiny, což vědcům umožňuje zabudovat fotocitlivé optogenetické regulátory do téměř jakéhokoliv proteinu, který chtějí studovat. Vystavení domén LOV modrému světlu přináší konformační změnu. S jistým promyšleným proteinovým inženýrstvím lze změnu použít k aktivaci nebo deaktivaci cílových proteinů. Doménu LOV lze použít k vyvolání cílené vazby DNA, dimerizaci proteinu a aktivaci nebo deaktivaci enzymu.
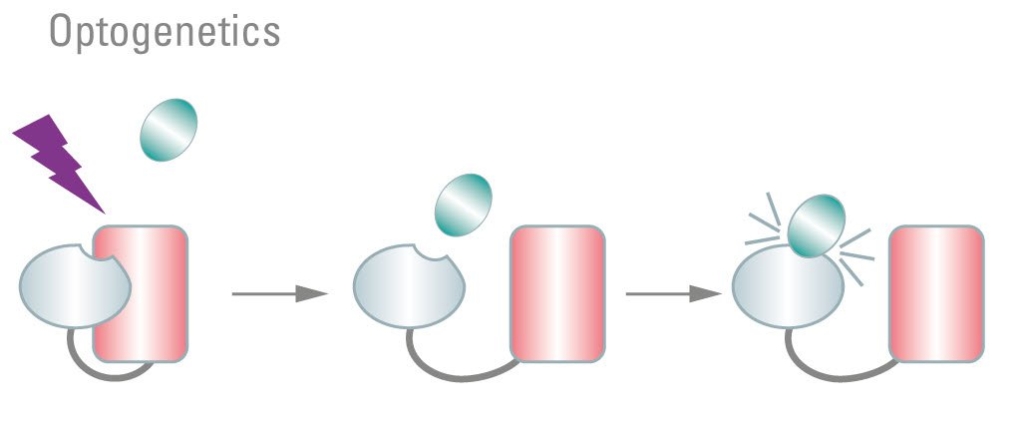
Obrázek 5: Optogenetika využívá fotocitlivé proteinové domény ke spuštění buněčných mechanismů. Ke změně membránového potenciálu byly klasicky používány fotosenzitivní iontové kanály. Mezitím zdomácněly další proteiny, které vykazují konformační změny po ozáření světlem. To lze využít k aktivaci nebo deaktivaci cílových proteinů, např. k indukci proteinů resp. vazbě DNA nebo aktivaci enzymu.
Jedním z příkladů použití domény LOV je její využití k výrobě fotocitlivé RAC kinázy. Aktivace umožňuje skupině účinně řídit pohyblivost buněk. Zajímavé je, že dokonce i nástroje pro úpravu genů, jako je CRISPR / Cas9, byly k zakoupení pod optickou kontrolou přidáním fotoindukovatelných dimerizačních domén s názvem Magnets, což umožňuje opticky zaměřitelné úpravy genů. Vznikající optogenetická sada nástrojů nabízí obrovský potenciál pro nové cesty výzkumu.
Řezání a ablace
Kromě použití k úpravě aktivity bílkovin nebo k fluorescenci barviv lze fotomanipulaci použít k manipulaci s fyzikálními a chemickými stavy samotného vzorku. Nahrazením kontinuálních laserů běžně používaných pro zobrazování vysokovýkonnými pulzními lasery je možné fyzicky zničit části vzorku nebo vyvolat fotolýzu chemických látek ve vzorku a kolem něj. Při řezání a ablaci může být výsledný efekt v závislosti na síle aplikované na vzorek velmi různorodý – od řezání jednotlivých cytoskeletálních vláken přes amputaci částí buňky až po úplnou ablaci buněčných shluků (viz obrázek 6). Tuto schopnost lze využít pro řadu různých aplikací, což uživatelům umožňuje studovat, jak organismy reagují na trauma, a definovat následné biologické dráhy účastnící se opravných procesů. Tyto schopnosti mají široké spektrum využití od zkoumání role jednotlivých mikrotubulů v mitóze až po mechaniky hojení ran, zánětů a metastatických procesů. Ablaci lze také použít k tvorbě ran ve tkáních, což vědcům umožňuje prozkoumat signální dráhy, migraci buněk a kinetiku zapojenou do složitých mnohobuněčných procesů. Ve vývojové biologii lze ablaci použít k vyřazení částí embrya, aby se zjistil dopad na vývoj a organizaci celého organismu.

Uvolňování látek
Fotomanipulační techniky mohou být dále využity k zavedení biologicky aktivních sloučenin do vzorku vysoce cíleným způsobem. Mnoho organických sloučenin podléhá fotolýze po vystavení UV záření. Pomocí organických chemických syntáz je možné navrhnout chemicky zapouzdřené sloučeniny, které jsou biologicky inertní, pokud jsou neporušené, ale které se při vystavení UV záření rozkládají na biologicky aktivní sloučeniny.
Takové sloučeniny se označují jako fotoaktivovatelné sloučeniny neboli “molekuly v kleci” a cílená fotolýza těchto sloučenin se označuje jako uvolňování. Běžné použití pro tyto sloučeniny je oblast neurobiologie, kde mohou být využity k zavedení aktivních neurotransmiterů do jednotlivých synaptických spojení. K dnešnímu dni je komerčně dostupná široká škála fotoaktivoatelných sloučenin, včetně neurotransmiterů (např. glutamát a GABA), nukleotidy (např. ATP a cAMP), iontů (vápník), a dokonce i některých makromolekul (viz obr. 7). Molekuly typu proteiny, peptidy, DNA a RNA lze také upravit na fotoaktiovatelné molekuly pomocí komerčně dostupných činidel, která kovalentně modifikují specifická rezidua.
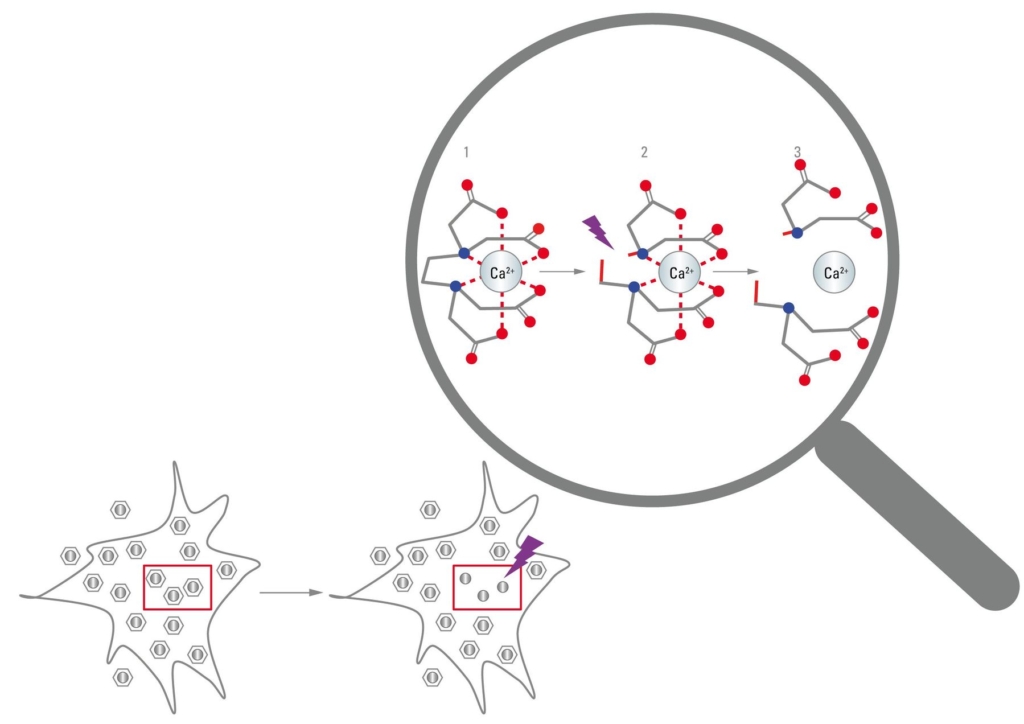
Obrázek 7: Uvolňování: Chemicky zapouzdřené bioaktivní látky, jako jsou vápenaté ionty, se nazývají “molekuly v kleci”. Pomocí UV světla může dojít k poškození chelátoru, což vede k uvolnění fotoaktivovatelné molekuly.
Kromě použití fotomanipulace k fyzickému zničení materiálu ve vzorku je také možné způsobit velmi specifické typy poškození buňky. Jedním z takových příkladů je použití UV laseru k zavedení cílených zlomů do DNA. Tuto techniku lze použít ke spuštění a studiu mechanismů opravy buněčné DNA. Mnoho proteinů podílejících se na rozpoznávání a reakci na poškození DNA hraje klíčovou roli jak při vývoji, tak při léčbě rakoviny, a proto schopnost aktivovat tyto dráhy na povel nabízí mimořádně cenný nástroj pro výzkum rakoviny.
Techniky fotomanipulace nabízejí extrémně všestrannou sadu výzkumných nástrojů, a to nejen již dříve popsané aplikace, ale také několik dalších, méně známých funkcí. Mezi ně patří použití infračervených laserů k vystavení buněk cílenému tepelnému stresu. Fotomanipulační zařízení lze také použít pro mikropatterning substrátů, včetně tisku proteinů a leptání na sklo, aby se získaly markery pro korelační mikroskopii. Multifotonové lasery lze také použít pro řadu fotomanipulačních technik, jako je řezání, uvolňování klecových molekul, fotopřepínání a fotostimulace, přičemž hlavní výhodou jsou vylepšené možnosti trojrozměrného cílení. Konečně stojí za zmínku, že je možné kombinovat techniky, jako je bělení, s aktivací markerů, např. mEOS, a získat tak hluboký vhled do některých složitých procesů. Dále mohou být použity techniky bělení a aktivace ke zkoumání změn v dynamických procesech, které se vyskytují před a po cílené stimulaci, pomocí uvolnění klecových molekul nebo optogenetických regulátorů, nebo k prozkoumání buněčných odpovědí na trauma z řezání či ablace.
Hardware pro fotomanipulaci
Pro fotomanipulaci lze použít několik různých typů technologií, z nichž všechny mají své silné a slabé stránky (viz obr. 8). Nejjednodušší přístup je použít clonu světelného pole v dráze fluorescenčního světla k osvětlení středu zorného pole specifickou vlnovou délkou a následným znovuotevřením clony a přepnutím na vlnové délky pro zobrazování. Tento přístup je pomalý, nabízí jen malou flexibilitu cílení a poskytuje pouze malou sílu osvětlení, takže pro většinu experimentů není vhodný. Je však dostatečný pro základní fotoaktivaci a lze jej použít k testování aktivity konstruktů. Protože ale většina experimentů s fotomanipulací vyžaduje energetičtější osvětlení, jsou preferovaným zdrojem osvětlení obvykle lasery. Laserová zařízení, jako je např. Leica WF FRAP, poskytují vynikající nástroje pro základní experimenty FRAP. Silný laserový zdroj je zaměřen na střed obrazu a profil paprsku ve vzorku lze upravit pomocí filtrů, které uživatelům umožňují pořizovat snímky studované oblasti o limitovaném rozpětí velikostí a tvarů. Omezením těchto zařízení je, že obvykle nabízejí jedinou laserovou linii, což limituje typy experimentů, pro které je lze použít. Dalším omezením je, že jelikož u nich nelze cílit na vícero nebo na složitější studované oblasti, mnoho experimentů je nad možnosti těchto zařízení.
Pokročilejší experimenty s fotomanipulací často vyžadují schopnost opakovaně cílit na jakoukoli oblast ve vzorku větším rozsahem vlnových délek. Tuto schopnost nabízejí především dvě technologie, a to digitální mikro-zrcadlová zařízení (DMD) a galvo skenery.
DMD zařízení používají čip, který obsahuje tisíce malých zrcadel, která lze vysokou rychlostí elektronicky přepínat do polohy zapnuto nebo vypnuto. Celý čip je osvětlen pomocí laseru nebo LED, v závislosti na skladbě aktivovaných zrcadel jsou pak uživatelé schopni promítat na svůj vzorek složité vzory osvětlení. DMD umožňují uživatelům současně osvětlovat více cílových oblastí. Hlavní slabinou DMD je relativně nízká maximální hustota výkonu, které jsou schopny dosáhnout, protože osvětlovací světlo je rozprostřeno po celém zorném poli. Díky tomu jsou DMD vhodné pro určité aplikace, např. některé optogenetické, ale potýkají se s vysokorychlostními energeticky náročnými aplikacemi, jako je bělení, řezání a ablace.
Skenovací zařízení typu galvo používají vysokorychlostní galvo skener k vedení zaostřeného laserového paprsku do vzorku, což z nich dělá nejuniverzálnější typ fotomanipulačního zařízení. Galvo skenery jsou často dostupné jako samostatná fotomanipulační zařízení, ale lze použít i mnoho konfokálních skenerů. V závislosti na připojených laserech mohou sloužit k téměř jakémukoli využití. Použití difrakčně omezeného paprsku umožňuje galvo zařízením velmi efektivně bělit a fotoaktivovat. Mohou být také použity pro řezání a ablaci. Některé galvo skenery mohou také regulovat profil paprsku, což umožňuje uživatelům větší flexibilitu při navrhování experimentů.
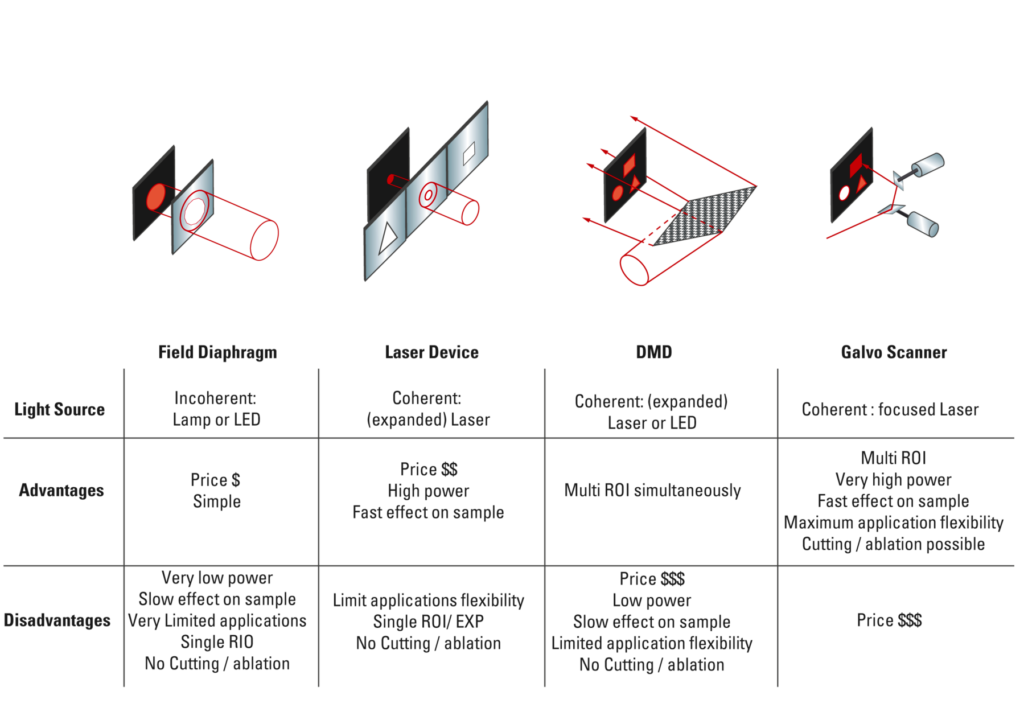
Obrázek 8: Možnosti hardwaru pro experimenty s fotomanipulací.
Je důležité si uvědomit, že fotomanipulační zařízení je pouze částí kompletního systému. Proto je třeba zvážit úroveň integrace zařízení do systému z hlediska optiky i softwaru. Dobře integrované zařízení by nemělo narušovat optickou cestu a software by měl umožňovat bezproblémové prokládání zobrazovacích a manipulačních úkolů. Měla by se také zvážit snadnost provozu vs schopnost navrhovat složité protokoly pokročilých experimentů.
Stručně řečeno, možnosti fotomanipulace nabízejí mimořádně výkonný doplněk k jakémukoli zobrazovacímu systému živých buněk díky obrovské škále možností, které mohou nabídnout. Fotomanipulaci lze použít k dosažení široké škály efektů na vzorek, přičemž techniky fotobělení a fotoaktivace umožňují uživatelům odhalit jinak skryté dynamické procesy. Uvolňování klecových molekul a rychle se rozvíjející pole optogenetiky nyní umožňují uživatelům stimulovat nebo inhibovat téměř jakoukoli biologickou dráhu se subcelulárním rozlišením a milisekundovou přesností. A konečně, techniky řezání a ablace umožňují provádět na vzorcích mikrooperace. Tyto schopnosti v kombinaci s moderními zobrazovacími systémy nabízejí obrovský potenciál pro další porozumění v celé řadě výzkumných oblastí.
(Převzato od společnosti Leica Microsystems, redakčně upraveno.)