Pokud to z názvu není dostatečně patrné, real-time PCR je aplikací PCR, která sleduje amplifikaci DNA v reálném čase. To znamená, že amplifikace je sledována během PCR reakce, nikoliv na konci reakce, jako u end-point PCR, kde jsou produkty PCR obvykle analyzovány po skončení reakce na agarózových gelech.
Tento článek je první ze dvoudílné série. V části 1 si projdeme základy real-time PCR, včetně jeho výhod oproti end-point PCR, pracovní postupy, typické datové výstupy, výběr dostupných systémů fluorescenčního značení a výhody a nevýhody každého z nich. Část 2 pak bude zahrnovat různé dostupné kvantifikační metody, tipy pro nastavení, design primeru a kontrolu kvality.
Real-Time PCR vs. qPCR vs. qRT-PCR atd.…
Protože je amplifikace DNA sledována v reálném čase na specializovaném přístroji pro PCR, je real-time PCR kvantitativní metodou, a proto se také běžně označuje jako qPCR (kvantitativní PCR). Pokud se real-time PCR používá k monitorování genové exprese pomocí kvantitativní analýzy cDNA (tj. reverzně transkribované RNA), lze jej označit jako real-time RT-PCR, qRT-PCR nebo modifikacemi těchto označení. Abychom předešli nejasnostem, budeme v celém tomto článku používat „real-time PCR“.
Standardní pokyny pro nomenklaturu real-time PCR a způsob reportování výsledků najdete v Informačním minimu pro publikaci experimentů kvantitativní real-time PCR (MIQE) [1].
Pracovní postup real-time PCR
Pracovní postup real-time PCR je poměrně přímočarý a nastavení reakce PCR je podobné jako u end-point PCR.

Během přípravy vzorku je vzorek (tj. váš templát) připraven izolací vysoce kvalitní DNA nebo RNA. Pro analýzy genové exprese je RNA podrobena reverzní transkripci, což poskytuje cDNA jako templát pro real-time PCR reakci.
Nastavení real-time PCR reakce je podobné jako pro reakci end-point PCR – připravíte (nebo zakoupíte hotový) PCR master mix obsahující všechny standardní komponenty pro PCR reakce, např. dNTPS, primery, pufr a polymerázu. Existuje však jeden hlavní rozdíl mezi reakční směsí end-point a real-time PCR. Jak je popsáno níže, jedná se o přidání fluorescenční reportérové molekuly k real-time PCR reakcím.
Kde do toho vstupuje ta „Real-Time“ část?
Monitorování amplifikace templátu v reálném čase je umožněno přítomností fluorescenční reportérové molekuly v každé PCR reakci, která produkuje fluorescenční signál, jehož intenzita se zvyšuje zároveň se zvyšujícím se množstvím amplikonu. Obecně řečeno, pro PCR v reálném čase existují dvě možnosti fluorescenčních reportérů:
• Barviva vázající DNA, např. SYBR green.
• DNA-specifické fluorescenční zhášecí sondy, např. Sondy SensiFAST ™, sondy TaqMan®, molekulární majáky a sondy Scorpions®.
Real-time termocyklery jsou vybaveny fluorescenčními detektory, které mohou monitorovat fluorescenční signál emitovaný během amplifikace. Množství změřené fluorescence je úměrné množství generovaného PCR amplikonu a změna fluorescenčního signálu v čase je použita k výpočtu množství amplikonu produkovaného v každém cyklu. Tímto způsobem lze provádět sběr dat v reálném čase.
Většina moderních nástrojů pro PCR v reálném čase obsahuje analytický software, který umožňuje vytvořit graf pro počet cyklů vs. intenzitu fluorescence, a poskytovat tak kvantitativní informace o amplifikované DNA. Jinak lze surová data z přístroje extrahovat a analyzovat ručně.
Křivka amplifikace real-time PCR
Typická real-time PCR reakce se provádí ve 40 cyklech, souhrnně označovaných jako „běh“. Amplifikační křivka je počátečním datovým výstupem každé real-time PCR reakce v rámci běhu. Jedna křivka představuje jednu reakci, a protože se real-time PCR obvykle provádí na vícejamkových stripech nebo destičkách, může jediný běh v reálném čase generovat velké množství křivek. Pro zjednodušení se podívejme na příklad jedné amplifikační křivky (obrázek 1).
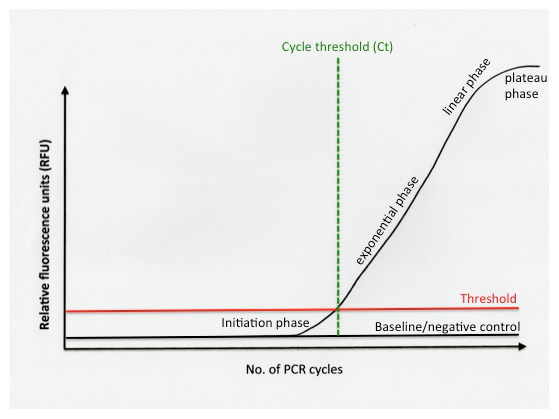
Obrázek 1. Křivka amplifikace real-time PCR.
Prahová hodnota
Prahová křivka označuje maximální úroveň fluorescence, kterou lze považovat za pozadí, tedy např. fluorescence, která bude detekována po navázání molekuly fluorescenčního detektoru na dsDNA v nepřítomnosti amplifikace. Nástroj real-time PCR obvykle vypočítává prahovou hodnotu automaticky, nebo ji může uživatel nastavit ručně. Základní hodnota (baseline) nebo negativní kontrola představuje úspěšnou negativní kontrolu, kde není detekována žádná fluorescence. Negativní kontroly by se vždy měly objevit pod hranicí prahové hodnoty.
Prahová hodnota cyklu (Ct)
Prvních několik cyklů běhu představuje iniciační fázi, kdy jsou všechny reakční složky v hojném množství. Počet amplikonů přítomných v každé reakci je ale příliš nízký na to, aby generoval fluorescenční signál, který by překračoval prahovou hranici. Jak běh postupuje, množství fluorescence detekované přístrojem překračuje prahovou hranici. Prahová hodnota cyklu (Cycle threshold – Ct) je číslo cyklu, při kterém fluorescenční signál emitovaný danou reakcí PCR dosáhne prahové hodnoty.
Jako velmi obecné pravidlo platí, že vzorky generující nízká Ct pravděpodobně obsahují velké množství cílové sekvence, zatímco vzorky s vysokými Ct obsahují nízké množství cílové sekvence. Hodnota Ct je také známá jako kvantifikační cyklus (Cq) nebo bod křížení (Cp).
Účinnost PCR
Během exponenciální fáze jsou všechny komponenty PCR reakce přítomny v hojném množství a počet produkovaných PCR amplikonů se exponenciálně zvyšuje za teoretického zdvojnásobení počtu amplikonu během každého cyklu. Zde se účinnost PCR * často vyjadřuje jako 2. Real-time PCR analýza přímo závisí na exponenciální fázi, protože poskytuje nejpřesnější data pro kvantifikaci, a protože se během exponenciální fáze vypočítává prahová křivka a Ct.
* Účinnosti PCR se budeme podrobněji věnovat v 2. části této série.
Během lineární fáze se amplifikace zpomaluje, protože se množství reakčních složek snižuje. Počet cyklů, při kterých reakce PCR vstupuje do lineární fáze, se může u jednotlivých vzorků lišit v závislosti na mnoha faktorech, např. množství přítomné templátové DNA. Reakce nakonec dosáhne tzv. fáze plató, kde fluorescenční signál zůstává konstantní.
Real-Time PCR je přesnější než end-point PCR
Během lineární fáze jakéhokoliv PCR běhu (end-point nebo real-time) se počet amplikonů nemusí nutně zvyšovat stejnou rychlostí v každé reakci. Některé reakce ve stejném běhu pravděpodobně dosáhnou lineární fáze dřív, než ostatní. Rozdíly mezi rychlostmi amplifikace jsou během fáze plató ještě výraznější, protože může být mnoho složek PCR vyčerpáno a některé reakce PCR se mohly úplně zastavit. Důležité je, že počáteční rozdíly v četnosti cílů u různých vzorků se v lineárních nebo plató fázích neprojeví.
Protože ke kvantifikaci dochází během exponenciální fáze v real-time PCR, získáme věrný obraz o množství přítomného amplikonu dříve, než se projeví výše uvedené rozdíly. Nicméně v end-point PCR se amplikony obvykle analyzují na agarózovém gelu na konci cyklu, což může být během fáze plató. Obrázek 2 ilustruje, že zatímco mnoho vzorků zobrazených v těchto amplifikačních křivkách pravděpodobně má podobná Ct, výsledky by byly úplně jiné, pokud by tyto vzorky byly analyzovány na agarózovém gelu!
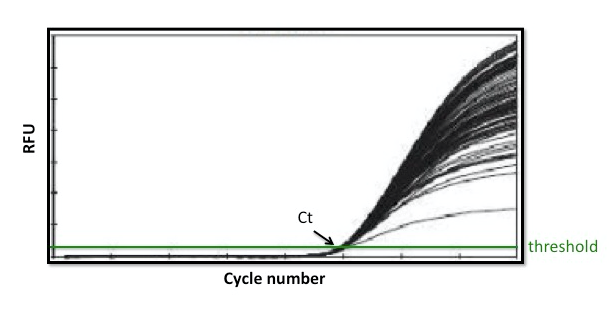
Obrázek 2. Real-time PCR vs. End-point PCR
Další výhody real-time PCR oproti end-point PCR
Kromě již zmíněných výhod se může real-time PCR oproti end-point PCR pochlubit řadou dalších výhod. Nejvýznamnější z nich jsou uvedeny v tabulce 1 níže.
| Tabulka 1: Real-time PCR vs. End-point PCR | |
| Zvýšená citlivost | Vysoká spolehlivost detekce cílů s nízkou četností kopií. |
| Možnost velmi širokého dynamického rozsahu: během jednoho běhu lze detekovat 1 až 1011 kopií cíle. | |
| Vysoce přesná kvantitativní data | Přesné měření absolutního počtu kopií genů a relativních změn genové exprese, protože zvýšení intenzity fluorescence je přímo úměrné množství přítomného cíle. |
| Formát uzavřené zkumavky eliminuje riziko křížové kontaminace, tj. data se získávají bez nutnosti znovu otevírat PCR zkumavky a zpracovávat agarosové gely. | |
| Rychlost | Odpadá čas strávený přípravou a analyzováním vzorků na agarózových gelech. |
Jak fungují systémy fluorescenčního značení?
Jak již bylo zmíněno dříve, existují dvě hlavní volby fluorescenčního reportéru pro real-time PCR – barviva vázající DNA a sekvenčně specifické fluorescenční zhášecí sondy. Rozhodnutí, která je pro vaši aplikaci vhodnější, bude záviset na mnoha faktorech a než půjdeme dále, podívejme se, jak tyto dva systémy fungují:
Barviva vázající DNA
• Tato barviva, z nichž je nejznámější SYBR Green, se nespecificky vážou na dvouvláknovou DNA (dsDNA).
• Molekuly barviva, které nejsou vázány na dsDNA, emitují velmi nízkou fluorescenci pozadí.
• Během amplifikace se barvivo interkaluje do nově syntetizované dsDNA a výsledný komplex DNA-barvivo emituje fluorescenci, která je detekována a zaznamenána real-time PCR přístrojem.
• Hlavní nevýhodou barviv vázajících DNA je to, že nevykazují sekvenční specificitu. To znamená, že se mohou vázat na dimery primerů a mimocílové amplikony. Při použití těchto barviv je proto klíčový design primeru. Zatímco je možné sledovat mimocílovou amplifikaci a tvorbu dimeru primeru pomocí následných kontrol kvality, mohou být v případě obav o specificitu nejlepší volbou DNA-specifické sondy.
Sekvenčně specifické fluorescenční zhášecí sondy
• Tyto sondy vážou DNA se sekvenční specificitou, a proto jsou obvykle navrženy pro každou cílovou sekvenci, která má být analyzována.
• Sondy se obvykle skládají ze 3 částí: oblasti vázající DNA, kovalentně vázaného fluoroforu na 5´ konci a zhášeče na 3´ konci.
• Intaktní sonda nevyzařuje fluorescenci, protože zhášeč v tom fluoroforu brání.
• Během PCR fáze extenze je syntetizována dsDNA a váže se na ni komplementární sonda. Jak se Taq polymeráza posouvá po templátu, dostává se do blízkosti sondy, kterou štěpí prostřednictvím své vlastní 5’→3′ exonukleázové aktivity. Tím se uvolní fluorofor od zhášeče a emituje se fluorescence.
U obou detekčních systémů je množství emitované fluorescence úměrné množství amplikonu přítomného v reakci.
Kterou molekulu pro detekci fluorescence mám tedy použít?
Skupiny výzkumníků, které analyzují velké množství genů, a kde se zaměření pravidelně mění, se často kvůli pohodlí a efektivitě nákladů rozhodnou pro barviva vázající DNA. Ti, kteří pracují se stejnou malou skupinou genů po delší dobu, mohou zjistit, že přínosy zvýšené specificity z dlouhodobého hlediska stojí za čas a úsilí investované do designu a validace sondy. Tabulka 2 níže poskytuje přehled výhod a nevýhod každého detekčního systému.
| Tabulka 2: Barviva vázající DNA vs. Sekvenčně specifické sondy | ||
| Pro | Proti | |
| barviva vázající DNA | Flexibilita – vhodná pro analýzu jakékoli sekvence dsDNA a bez nutnosti návrhu vlastního designu sondy. | Falešné pozitivity způsobené neschopností barviva rozlišovat cílené a mimocílové amplikony a dimery primerů. |
| Ekonomické ve srovnání se sondami navrženými na zakázku. | Může se ukázat jako velmi časově náročný přístup.
Primery mohou vyžadovat rozsáhlou optimalizaci, aby se vyloučila mimocílová amplifikace. |
|
| Přímočarý postup:
Není potřeba náročný design sondy. |
Křivka tání po běhu je nezbytná pro monitorování a vyloučení mimocílové amplifikace. | |
| Sekvenčně specifické sondy | Zvýšená specificita, protože pro signál je nutná specifická hybridizace mezi sondou a cílem. | Může být časově náročné v závislosti na tom, jak komplexní je design sondy. |
| Možné multiplexní reakce:
Sondy mohou být označeny odlišnými barvivy. |
Nákladné, protože pro každý cíl je nutná jiná sonda. | |
| Může ušetřit čas a peníze v závislosti na tom, jak často bude daná sonda použita.
Nejsou třeba křivky tání po běhu, protože sonda zajišťuje specificitu. |
Riziko falešných negativit, protože sonda nemusí identifikovat varianty sestřihu (je nutné ověření). | |
To je vše z 1. části. Nenechte si ujít ani část 2, ve které tuto sérii dokončíme pohledem na různé dostupné kvantifikační metody v reálném čase, tipy pro nastavení a kroky kontroly kvality, které vám pomohou pokaždé dosáhnout vysoce kvalitních real-time PCR výsledků.
Reference
1. Bustin SA, Benes V, Garson JA, Hellemans J, Huggett J, Kubista M, et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clin Chem. 2009;55(4):611-22.
(Převzato od společnosti Nordic BioSite, redakčně upraveno.)