Autor: Valerie Jones
Co jsou to aptamery?
Aptamery, často popisované jako syntetické protilátky, jsou jednovláknové molekuly DNA nebo RNA, které se skládají do sekundárních struktur, a které se mohou vázat na cílové molekuly s vysokou afinitou a specificitou. V roce 1990 byl vyvinut první aptamer, a to proti T4 DNA polymeráze pomocí RNA [1]. Od té doby se významně rozšířily jak metody výběru aptamerů, tak jejich následné aplikace. Aptamery lze nyní vyvíjet z molekul RNA i DNA, stejně tak jako za použití nepřirozených bází, cukr-fosfátových páteří polynukleotidů a malých molekul. Mezi jejich aplikace patří: detekční molekuly v analýzách podobných ELISA testu, proteinově specifické barvení tkáně, cílené podávání léků a také léčba makulární degenerace, jenž byla schválena FDA [2,3].
Aptamery vs. protilátky: výhoda aptamerů
Díky své silné vazebné afinitě a vysoké specificitě pro malé biomolekuly vyvolaly aptamery velký zájem jakožto alternativa k protilátkám. Srovnání vlastností aptamerů a protilátek je shrnuto níže.
| APTAMER | PROTILÁTKA | |
| Vlastnosti | Vyšší specifita oproti protilátkám | Vyšší afinita oproti aptamerům |
| Stabilita a skladování | Dlouhá životnost při pokojové teplotě | Dlouhá životnost při zmrazení |
| Po několika kolech opakovaného rozmrazení a zmrazení zůstává stabilní | Po několika kolech opakovaného rozmrazení a zmrazení degraduje | |
| Může být navržen tak, aby odolával enzymům | Nemůže být navržena tak, aby odolávala enzymům | |
| Lze jej digitálně „uložit“ a znovu syntetizovat za nízkou cenu | Je vyžadováno skladování a údržba hybridomů | |
| Vývoj a škálovatelnost | 3-5 měsíců (selekce & sekvenování) | 6-9 měsíců (imunizace & vývoj hybridomů) |
| Nejsou vyžadována zvířata | Je vyžadováno využití zvířat | |
| < 1 týden na doplnění | 3-4 týdny na doplnění | |
| Velmi nízká variabilita mezi jednotlivými dávkami | Nízká až mírná variabilita mezi jednotlivými dávkami | |
| Cílová molekula | Může být použit jakýkoliv cíl | Cíl je omezen jen na imunogenní, netoxické molekuly |
| Špatné imunogeny nebo malé molekuly: ke zvýšení selekce není nutná žádná konjugace | Špatné imunogeny nebo malé molekuly: je potřebný nosný protein ke zvýšení imunogenicity | |
| Množství potřebné pro selekci: 100 µg proteinu / 1 mg malé molekuly | Množství potřebné pro imunizaci: 5 mg proteinu / 5 mg konjugovaného peptidu | |
| Modifikace | Snadno konjugovatelné s proteiny, peptidy, léky a jinými malými molekulami | Snadno konjugovatelné s proteiny, peptidy, léky a jinými malými molekulami |
| Lze jej upravit pomocí fluorescenčních barviv | Lze jej upravit pomocí fluorescenčních barviv | |
| Biotinylace ~$100 / mg | Biotinylace ~$1000 / mg | |
| Cena | Selekce individuálního aptameru: začíná na $5,500 | Monoklonální protilátka: začíná na $4000 |
| “Polyklonální” obohacený pool aptamerů: $1000 | Polyklonální protilátka: začíná na $1200 |
Techniky SELEX
Aptamery jsou vyvíjeny za použití procesu známého jako SELEX (Systemic Evolution of Ligands by Exponential Enrichment – systematická evoluce ligandů exponenciálním obohacením). Během SELEXu se biliony náhodných DNA oligonukleotidů smíchají s cílovou molekulou a sekvence, které se navážou k cíli, jsou poté shromážděny a amplifikovány. Po několika kolech selekce je DNA sekvenována a jednotlivé sekvence jsou poté hodnoceny, co se týče vazby. Pomocí SELEXu lze aptamery vyvíjet s afinitou k různým cílům, včetně proteinů, peptidů a malých molekul.
Obecně se SELEX provádí ve 3 fázích.
1. Selekce: Sekvence DNA, které se navážou na cíl, jsou odděleny od sekvencí, které tak neučiní. Vazebné sekvence jsou amplifikovány pomocí PCR a přeneseny do dalších kol SELEXu (obvykle 5-10 kol).
2. Sekvenování: RayBiotech používá NGS a analýzu dat k určení, které aptamery se mají vyhodnotit, na rozdíl od náhodného výběru jednotlivých klonů.
3. Hodnocení kandidátů: Aptamery jsou hodnoceny z hlediska vazby a nejlepší aptamer je pak dodáván zákazníkovi
Vlastní aptamerový servis společnosti RayBiotech zahrnuje do svého procesu SELEX nejmodernější techniky pro generování vysoce kvalitních aptamerů. Protože technika selekce může určitým způsobem zkreslit vývoj poolu aptamerů, přizpůsobují strategii selekce tak, aby co nejlépe vyhovovala potřebám každého zákazníka. To často zahrnuje použití více technik selekce v rámci jednoho projektu ke generování nejlepších aptamerů. Například v mnoha výběrech začínají kapilární elektroforézou SELEX (CE-SELEX), aby identifikovali aptamery, které se vážou na všechny povrchy proteinového cíle, čímž obohacují zásobu potenciálních vazebných partnerů. Tato skupina aptamerů se poté použije v následném typu metody SELEX, který se více podobá konečnému testu, ale nemá takovou schopnost oddělit vazebné a nevazebné sekvence. Protože pool aptamerů byl již o vazebné partnery obohacen, lze se zaměřit na zjišťování toho, kteří z těchto vazebných partnerů fungují nejlépe přímo v konkrétním testu zákazníka.
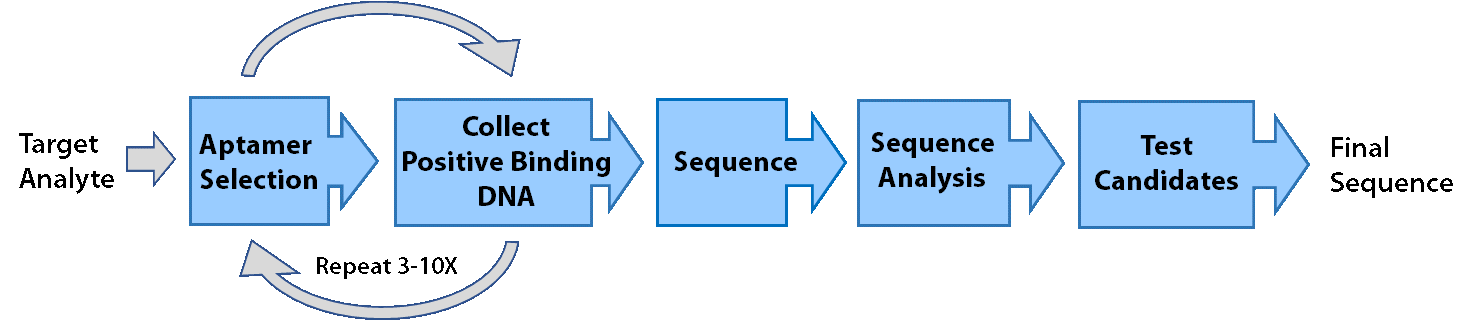
I když je možné použít širokou škálu technik a variant selekce, lze je rozdělit do tří obecných typů. Tyto techniky nejsou zcela úplným seznamem typů SELEX, byly vyvinuty nebo jsou používány firmou RayBiotech, a představují tak pouze některé z technik, které jsou běžně používány:
1. Tradiční selekce: Tradiční selekční technika vyžaduje, aby byl cíl zájmu navázán na pevný nosič. Tímto nosičem mohou být kuličky, stěny mikrotitrační destičky nebo gelové kolonky. Aptamery se poté váží na imobilizovaný cíl a molekuly, které se nenavázaly, jsou odstraněny. Zbývající navázané aptamery jsou shromážděny a přeneseny do dalšího kola. Tento typ selekce je nejvhodnější pro větší cíle, jako jsou peptidy a proteiny, i když lze tuto metodu použít i pro jiné molekuly. Výhodou této selekční techniky je, že nabízí dobré oddělení mezi vazebnými a nevazebnými sekvencemi DNA, avšak za cenu toho, že budou potenciálně identifikovány i aptamery proti linkeru nebo nosiči, ke kterým je cíl navázán. Navíc pokud je cíl menší, může tato technika omezit počet povrchů dostupných pro vazbu aptameru.
2. Reverzní selekce: Tato varianta je podobná variantě tradiční selekce, kromě toho, že knihovna aptamerů je vázána na pevný nosič, který se poté setkává s cílem zájmu. V závislosti na strategii selekce mohou být navázané aptamery poté shromažďovány sekundárním zachycením cíle nebo uvolněním navázaných aptamerů z jejich pevného nosiče. Výhodou reverzní selekce je to, že sledovaný cíl není na nic vázán ani nijak upravován, což umožňuje aptamerům rozpoznat cíl v jeho nativní formě, což činí tento typ selekce ideálním pro menší molekuly. Účinnost separace mezi vazebnými a nevazebnými sekvencemi DNA je však obecně nižší než u jiných typů selekce, což vede k delší době selekce.
3. CE selekce: Tradiční metoda vyžaduje, aby byl cíl navázán na pevný nosič, který potenciálně může změnit cíl, proti kterému je aptamer vybrán. Metoda CE se používá k oddělení vazebných sekvencí, což umožňuje interakci DNA s volným proteinem v roztoku. To umožňuje těmto dvěma molekulám napodobovat jejich přirozené interakce v séru nebo jiných tekutinách. Účinnost separace CE selekce je navíc velmi vysoká, což znamená, že k obohacení poolu aptamerů je zapotřebí méně cyklů selekce. Zatímco tradiční SELEX může vyžadovat 10 nebo více kol selekce, CE selekce dokáže efektivně identifikovat aptamery už za 3 kola, což pomáhá snižovat negativní efekt chyb vznikajících během PCR na selekci [4,5]. Použití metody CE také umožňuje sledovat vývoj knihovny aptamerů během celého procesu selekce.
Kromě různých selekčních technik lze využít k identifikaci jednotlivých aptamerů místo technik klonování plasmidů také sekvenování nové generace (NGS). Data získaná pomocí NGS lze využít k analýze celého poolu aptamerů a k identifikaci běžných sekvencí aptamerů, motivů a dalších vzorů v knihovně. Používání těchto informací umožňuje používat data z analýz k identifikaci lepších kandidátů aptamerů než těch, které byly identifikovány pouze náhodně vybranými klony, což zvyšuje pravděpodobnost úspěchu.
Poté, co jsou identifikovány kandidátské sekvence, jsou nasyntetizovány a je hodnocena jejich schopnost vázat se na požadovaný cíl. Použité techniky se mohou lišit v závislosti na typu cíle a konečné aplikaci aptameru. Stejně jako u protilátek může konečná aplikace ovlivnit chování aptameru, a proto může být použito více technik, aby byla určena výsledná funkčnost konečného aptameru.
(Převzato od společnosti RayBiotech, redakčně upraveno.)
Literatura:
1. Tuerk, Craig, and Larry Gold. “Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase.” Science 249.4968 (1990): 505-510.
2. Vinores, Stanley A. “Pegaptanib in the treatment of wet, age-related macular degeneration.” International journal of nanomedicine 1.3 (2006): 263.
3. Bauer, Michelle, et al. “The Application of aptamers for immunohistochemistry.” Nucleic acid therapeutics 26.3 (2016): 120-126.
4. Stuart, Christopher H., et al. “Selection of a Novel Aptamer Against Vitronectin Using Capillary Electrophoresis and Next Generation Sequencing.” Molecular Therapy—Nucleic Acids 5.11 (2016): e386.
5. Mosing, Renee K., and Michael T. Bowser. “Isolating aptamers using capillary electrophoresis–SELEX (CE–SELEX).” Nucleic Acid and Peptide Aptamers: Methods and Protocols (2009): 33-43.