Úvod
Fosforylace proteinů je nejlépe prozkoumaná posttranslační modifikace (PTM), při níž je fosforylová skupina z adenosintrifosfátu (ATP) kovalentně připojena k serinu (~86 %), threoninu (~12 %) nebo tyrosinu (~2 %) kinázou a odstraněna fosfatázou (obrázek 1). [1] Byly zaznamenány i případy fosforylace na jiných aminokyselinách. [2] Fosforylace může měnit strukturu, funkci a interakce proteinů. Fosforylace jako taková hraje klíčovou roli prakticky ve všech buněčných procesech ve stavu homeostáze i nemoci, včetně přenosu signálu, buněčného cyklu, diferenciace, proliferace, metabolismu, motility a smrti. [3,4] Důležité je, že může fosforylace na různých zbytcích způsobit různé následky. Například RAF1 je kináza ústřední pro dráhu MAPK, která se aktivuje, když je fosforylována na serinových (S) nebo threoninových (T) zbytcích S259, S338, S340/341, T491 nebo S494. [5,6] Fosforylace na S289/296/301 však vede k inhibici kinázové aktivity RAF1. [7] Pochopení specifických míst a úrovně fosforylace je pro pochopení buněčné signalizace a fenotypu velmi důležité. V tomto článku je diskutováno a porovnáváno sedm výzkumných nástrojů pro studium fosforylace proteinů.
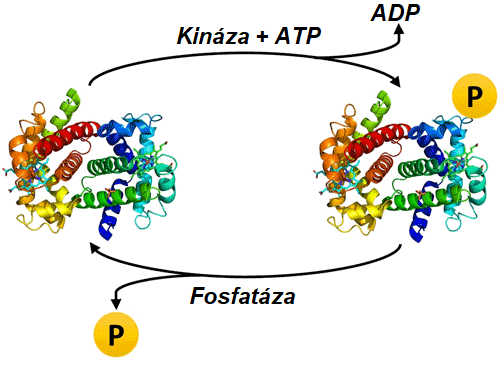
Obrázek 1: Přidávání a odebírání fosforylace proteinů prostřednictvím kináz a fosfatáz.
Výzkumné metody
– SDS-PAGE
– Western blot
– Průtoková cytometrie
– Kinázový test
– ELISA
– Array
– Hmotnostní spektrometrie
Polyakrylamidová gelová elektroforéza s dodecylsulfátem sodným (SDS-PAGE)
Proteiny ve vzorku – často buněčné nebo tkáňové lyzáty – se nejprve rozdělí podle velikosti pomocí SDS-PAGE. To je možné, protože záporně nabitý dodecylsulfát sodný (SDS) v pufru a gelu působí na všechny aminokyseliny rovnoměrně záporným nábojem, což umožňuje rozdělit bílkoviny v elektrickém poli spíše podle velikosti než podle jejich jedinečného obsahu aminokyselin a náboje (obrázek 2A). [8] Proteiny lze poté vizualizovat pomocí barviva Coomassie blue nebo barvení stříbrem. Stojí za zmínku, že SDS-PAGE s barvením pomocí Coomassie blue nebo stříbrem lze použít zejména k detekci některých fosforylačních událostí, které způsobují, že proteiny migrují pomaleji než jejich nefosforylované protějšky. Jasnou nevýhodou tohoto přístupu je, že nelze vyloučit migrační posuny způsobené jinými faktory (např. glykosylací). Vzhledem k tomu, že se tímto přístupem obarví všechny proteiny, provádí se poté především analýza purifikovaných proteinů. Důležitým faktorem je zahrnutí vhodných kontrol (viz rámeček „Experimentální kontroly“).
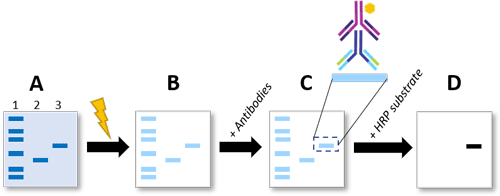
Obrázek 2: Postup Western blottingu pro detekci fosforylovaných proteinů. A) Proteiny jsou separovány pomocí SDS-PAGE, kde sloupec 1 = proteinový žebříček, sloupech 2 = nefosforylovaný protein, a sloupec 3 = fosforylovaný protein. B) Proteiny jsou přeneseny na membránu pomocí napětí. C) Membrána se inkubuje s protilátkou specifickou pro fosforylované místo zájmu a poté se sekundární protilátkou konjugovanou s HRP. D) Po přidání substrátu HRP se pomocí chemiluminiscence detekuje vazba protilátky (na proužek/band představující fosforylovaný protein).
rámeček “Experimentální kontroly”
Tradičnější přístup k detekci fosforylovaných proteinů pomocí SDS-PAGE využívá radioaktivně značené ATP během kinázových reakcí. Fosforylovaný protein se pak detekuje prostřednictvím inkorporovaného radioaktivně značeného ATP pomocí autoradiografie, fluorografie nebo fosforového zobrazování. [8] Na rozdíl od Coomassie blue nebo stříbrného barvení umožňuje použití radioaktivně značeného ATP specifickou detekci nepurifikovaných fosforylovaných proteinů. Bohužel radioaktivní značení nemusí být vhodné pro všechny fosforylační události a také představuje zdravotní rizika. Alternativy k použití radioaktivně značeného ATP k detekci fosforylovaných proteinů zahrnují barvení methylovou zelení po hydrolýze fosfoesterové vazby, použití fluorescenčního barviva, které se specificky váže na fosforylové skupiny (např. Pro-Q Diamond), nebo použití chelatace kovů ke konjugaci barviva s fosforylovou skupinou. [9] Například Phos-Tag™ je dvoujaderný komplex kovů, který se při neutrálním pH silně váže na fosforylovou skupinu. [10] Phos-Tag™ je předem vpraven do gelu a výrazně inhibuje migraci fosforylovaných proteinů bez ohledu na místo fosforylace. Jakákoli fosforylace tak bude mít za následek pomalejší migraci než nefosforylovaný protein a protein s několika fosforylačními událostmi může mít za následek více proužků/bandů, které jsou od sebe snadno rozeznatelné. Purifikované proteiny lze analyzovat pomocí Coomassie barvení nebo barvení stříbrem, zatímco nepurifikované proteiny lze analyzovat pomocí western blottingu (viz další část). Phos-Tag™ lze použít ve spojení s dalšími aplikacemi (např. western blotting, hmotnostní spektrometrie) k detekci fosforylovaných proteinů.
Relativní rozdíly v intenzitách proužků/bandů při různých úpravách vzorků pomocí SDS-PAGE se porovnávají vizuálně, ale k získání semikvantitativních dat lze extrahovat denzitometrický signál. Kvantitativní údaje je možné získat při analýze SDS-PAGE pomocí standardní křivky, ale to se obvykle neprovádí. [11]
Výhody:
– Snadné provedení
– Používá zcela běžné laboratorní vybavení (detektor bílého světla).
– Vyžaduje nízkou až střední zručnost
– Phos-Tag™: Pomalejší migrační vzorec pro všechny fosforylační události, flexibilní použití v různých aplikacích
– Jednoduchá interpretace dat
– Nezávislost na protilátkách
Nevýhody:
– Radioaktivně značený ATP: potenciální nebezpečí pro zdraví; vyžaduje autoradiografii, fluorografii nebo fosforové zobrazování
– Coomassie nebo stříbrné barvení: mnoho fosforylačních událostí nevede k viditelně pomalejší migraci ve srovnání s nefosforylovanými proteiny
– Rozlišení mezi různými izoformami proteinů nemusí být možné
– Není kvantitativní
– Nízká propustnost (throughput)
– Nelze určit specifické místo fosforylace
Western blotting
Western blotting je zlatým standardem pro kvalitativní měření hladin fosforylace. Po separaci proteinů pomocí SDS-PAGE se proteiny po přiložení napětí přenesou z gelu na membránu (obrázek 2). [12] Na membránu se přidá protilátka specifická pro fosforylaci, která je předmětem zájmu. Na protilátku proti fosforylaci se pak naváže sekundární protilátka konjugovaná s křenovou peroxidázou (HRP). Vazba protilátky se detekuje po přidání substrátu HRP, což vede k chemiluminiscenci.
Citlivost a specifičnost Western blotu závisí na použitých protilátkách (viz rámeček „Protilátky proti fosforylaci“). Pokud se protilátka nespecificky váže na jiné bílkoviny ve vzorku, může molekulová hmotnost bílkoviny a migrační vzorec ve srovnání s proteinovým žebříčkem často pomoci určit, který proužek/band je bílkovinou zájmu. To však může být problematické, pokud se protilátka váže na více izoforem bílkovin s podobnou hmotností. Jak již bylo zmíněno, fosforylované proteiny mohou migrovat jinak, než se očekává.
rámeček “Protilátky proti fosforylaci”
Výhody:
– Oblíbený / zlatý standard
– Používá zcela běžné laboratorní vybavení (chemiluminiscenční detektor)
– Vyžaduje mírnou zručnost
– Jednoduchá interpretace dat
– Lze identifikovat specifické místo fosforylace
– Může být kvantitativní, pokud je k dispozici purifikovaný fosforylovaný protein (není běžné).
Nevýhody:
– Detekce jednoho komplexu proteinů
– Tradičně vyžaduje 1 až 2 dny. K dispozici jsou však i kratší varianty. Například společnost Bio-Rad nabízí systém Trans-Blot® Turbo™ Transfer, který dokáže zkrátit dobu přenosu z gelu na membránu z 1 hodiny na 7 minut. [17] Další metodou je imunoprobing, při kterém je SDS-PAGE gel zapouzdřen jako kapilární systém. [18] Přenos gelu není nutný, což vede ke zkrácení doby zpracování a menší potřebě řešení různých problémů (díky snížení počtu kroků) než u tradičního western blottingu.
– Často je nutná optimalizace a řešení různých problémů (např. délka inkubace protilátek, nalezení správné protilátky, použití správného blokovacího činidla).
– Není kvantitativní (obvykle)
– Rozlišení mezi různými izoformami proteinů nemusí být možné (závisí na protilátce).
– Nízká výtěžnost (throughput)
– Závislé na protilátce
Průtoková cytometrie
Průtoková cytometrie je kapalinová metoda, při níž jsou jednotlivé buňky charakterizovány pomocí fluorescenčně konjugovaných protilátek cílících na specifické proteiny zájmu (obrázek 3). [19] Lze také měřit životaschopnost buněk. Získaná střední intenzita fluorescence (MFI) fluoroforu protilátky je úměrná počtu proteinů zájmu; čím vyšší je tedy MFI, tím vyšší je hladina antigenu. Průtoková cytometrie se primárně používá k detekci povrchových buněčných proteinů; lze však analyzovat i intracelulární proteiny, jako jsou fosforylované proteiny. Neobarvené buňky nebo buňky obarvené stejnou kontrolní protilátkou konjugovanou s fluoroforem by měly být použity jako negativní kontrola, která pomůže určit autofluorescenci a nespecifickou vazbu vybraných protilátek (obrázek 4). Další negativní kontrolou je „izotypová kontrola“, při níž se buňky barví protilátkou, která je zaměřena na protein zájmu. Izotypová kontrola zajišťuje, že MFI fosfoprotilátky je specifický pro fosforylovaný protein zájmu, a nikoli artefakt. Přesné počty buněk a relativní násobné změny se získají pomocí průtokové cytometrie.
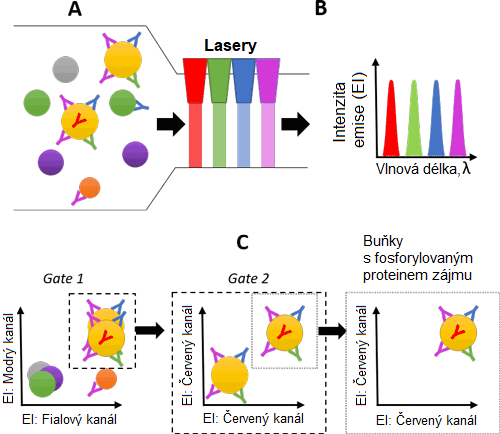
Obrázek 3: Schéma procesu průtokové cytometrie. A) Buňky reprezentující různé typy buněk jsou inkubovány s fluorescenčně konjugovanými protilátkami cílícími na proteiny zájmu. Každá z různých protilátek má specifický fluorofor. Y = protilátka, kde různě zbarvené protilátky představují různé fluorofory. B) Průtokový cytometr používá lasery k vyšetřování velikosti, tvaru a intenzity fluorescenční emise (EI) každé buňky. C) Populaci buněk, která je předmětem zájmu, lze vybrat pomocí správné kombinace fluoroforů („gating“). Pomocí této strategie lze buňky zájmu spočítat a charakterizovat.
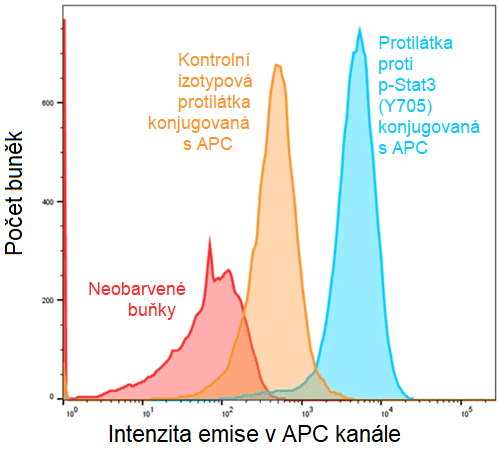
Obrázek 4: Histogram počtu buněk s emisemi ve fluorescenci allofykocyaninu (APC)
Výhody:
– Multiplexní detekce proteinů
– Charakterizace buněčné populace
– Lze měřit životaschopnost buněk
– Používá běžné laboratorní vybavení (průtokový cytometr)
– Vysoká propustnost (throughput) při použití 96-jamkového vzorkovače
Nevýhody:
– Vyžadují specializované školení
– Rozlišení mezi různými izoformami proteinů nemusí být možné (závisí na protilátce)
– Není kvantitativní
– Závislé na protilátce
Testy kinázové aktivity
Kinázovou aktivitu lze stanovit pomocí testu kinázové aktivity in vitro, při kterém se smíchá purifikovaná kináza a nefosforylovaný substrát s radioaktivně značeným ATP. [20] Substrát se následně analyzuje na fosforylaci prostřednictvím radioaktivně značené fosforylové skupiny. Počet scintilací je přímo úměrný množství fosforylovaného substrátu. Jiné in vitro kinázové testy nepoužívají radioaktivně značený ATP, ale používají detekční protilátku specifickou pro ADP (např. Adapta™) nebo fosforylované místo zájmu (např. LANCE®). Další variací na toto téma je časově rozlišený fluorescenční rezonanční přenos energie (TR-FRET), který využívá fluorescenční molekulu ATP zvanou „tracer“ a párovou, fluorescenčně značenou protilátku proti kináze. [21] V nepřítomnosti substrátu vytvářejí protilátka a tracer signál TR-FRET. Jakmile kináza fosforyluje substrát více pomocí ATP traceru, signál TR-FRET se sníží. Tuto výzkumnou metodu obvykle používají vývojáři léčiv k identifikaci nových substrátů kináz nebo ke screeningu malých molekul inhibitorů kináz.
Výhody:
– Vysoce výkonný (high throughput) screening
– Vynikající platforma pro objevování a screening léčiv
Nevýhody:
– Radioaktivně značený ATP: potenciální nebezpečí pro zdraví; vyžaduje autoradiografii, fluorografii nebo fosforové zobrazování
– K purifikaci nebo detekci proteinů, které jsou předmětem zájmu, mohou být nutné protilátky
– Výsledky in vitro nemusí vždy odpovídat aktivitě in vivo
Enzymově vázaný imunosorbentní test (ELISA)
Tradiční sendvičová ELISA používá k detekci proteinu zájmu dvě protilátky: jedna protilátka zachycuje protein zájmu, zatímco druhá protilátka se používá k jeho detekci (obrázek 5) (viz rámeček „Sendvičové imunoanalýzy: Hledání správného páru protilátek“). [23] Pro detekci fosforylovaného proteinu pomocí metody ELISA váže jedna protilátka celkový protein, zatímco druhá protilátka váže fosforylační místo; nejlepší konfiguraci záchytu/detekce musí být empiricky určena vývojářem ELISA (viz rámeček „Experimentální kontroly“). Stručně řečeno, záchytná protilátka, která je imobilizována na 96-jamkové destičce, se po aplikaci vzorku váže na protein zájmu. Následná vazba detekční protilátky konjugované s HRP vede k tomu, že protein zájmu je „vložen” (sendwiched) mezi obě protilátky. Modrá barva vzniká při reakci HRP s přidaným substrátem a tato reakce je zastavena přidáním kyseliny sírové, která změní barvu ze žluté na modrou. Úroveň absorbance (tj. optická densita, OD) při vlnové délce 450 nm je přímo úměrná množství detekovaného proteinu zájmu.
Obrázek 5: Konfigurace sendvičové imunoanalýzy
rámeček “Sendvičové imunoanalýzy: Hledání správného páru protilátek”
Nalezení dvou protilátek, které lze spárovat v sendvičové imunoanalýze, může vyžadovat rozsáhlý screening protilátek. [22] Protilátky se musí nejen vázat na oddělené oblasti (nebo epitopy) na stejném proteinu, ale epitopy musí být přístupné pro vazbu na platformě. V některých případech nemusí dvě protilátky fungovat jako pár záchyt-detekce, ale spíše v konfiguraci detekce-záchyt.
Koncentrace proteinu zájmu se zjišťuje pomocí standardní křivky, která se vytvoří přidáním známého množství purifikovaného cíle. Zatímco tradiční metody ELISA jsou kvantitativní, většina fosforylačních ELISA metod je semikvantitativní, protože pro vytvoření standardní křivky nepoužívají purifikovaný fosforylovaný protein nebo peptid. Jako pozitivní kontrola se spíše používá buněčný lyzát, který obsahuje fosforylovaný protein zájmu, aby se zjistil lineární rozsah OD přístroje; standardní křivka se nevytváří. Naštěstí se stává stále více kvantitativních fosforylačních ELISA testů komerčně dostupných. Srovnání dat z western blotu a ELISA je uvedeno na obrázku 6; údaje jsou podobné.
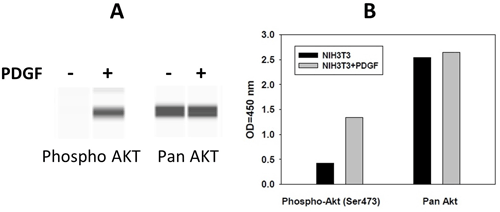
Obr. 6: Srovnání výsledků při použití A) imunotestování (immunoprobing) a B) sendvičového testu ELISA. Buňky NIH3T3 byly napěstovány do 80% konfluence a poté byly přes noc zbaveny séra. Buňky byly buď neošetřeny, nebo jim byl po dobu 10 min aplikován PDGFβ, který nezvýšil celkové množství AKT, ale zvýšil množství fosforylovaného AKT na serinu 473.
Jednotlivé ELISA se mohou lišit od toho, co je stručně popsáno výše. ELISA prováděná na destičkách může využívat destičky s vyšší hustotou. ELISA dokonce nemusí používat destičku, ale kuličku (např. SIMOA®). Buňky mohou být kultivovány a jejich fosforylované proteiny analyzovány pomocí buněčné metody ELISA. Kompetitivní ELISA používá pouze záchytnou protilátku, a proto se považuje za metodu s nižší specifitou než sendvičová ELISA. [24]
Výhody:
– Využívá zcela běžné laboratorní vybavení (čtečka destiček)
– Vyžaduje nízkou až střední zručnost
– Vysoká propustnost (throughput) (tj. jedno fosforylační místo v mnoha vzorcích analyzovaných současně)
– Sběr dat je obvykle dokončen za méně než 1 den
– Jednoduchá interpretace dat
Nevýhody:
– Detekce jednoho komplexu proteinů
– Rozlišení mezi různými izoformami proteinů nemusí být možné (závisí na protilátce)
– Většina fosforylačních ELISA testů není kvantitativní
– Závislost na protilátce
Protilátkové soupravy (array)
Multiplexní detekce fosforylovaných proteinů je možná pomocí sendvičových protilátkových souprav zvaných “array” [viz také „Enzymově vázaný imunosorbentní test (ELISA)” ], ve kterých jsou protilátky imobilizovány na skle, membráně nebo kuličkách (obrázky 6, 7). [25,26] Po blokovacím kroku se vzorky inkubují se soupravami (arrays). Nespecifické proteiny se poté odmyjí a matrice se inkubují s detekčními protilátkami, což umožňuje chemiluminiscenční nebo fluorescenční analýzu. Signál je přímo úměrný množství proteinu vázaného protilátkami. Srovnání údajů z western blotu, ELISA a protilátkových souprav (obrázky 6, 8) ukazuje, že všechny tři metody odrážejí podobné změny fosforylace při působení PDGFβ na buňky NIH3T3. Zatímco kvantitativní údaje lze získat pomocí protilátkových souprav, žádné kvantitativní soupravy zaměřené na fosforylované proteiny nejsou komerčně dostupné. Díky bodovému značení nebo značení různých protilátek v adresovatelném formátu je identifikace proteinů jednoduchá.

Obrázek 7: Obrázky soustavy (array) protilátek. (Vlevo) Chemiluminiscenční detekce signálu proteinů pomocí membránového pole. (Vpravo) Fluorescenční detekce signálu proteinů pomocí pole založeného na skleněném sklíčku.
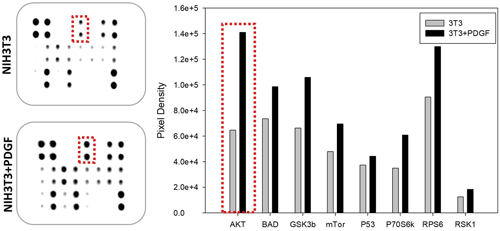
Obrázek 8: Soustava (array) protilátek proti fosforylaci inkubované s lyzáty buněk NIH3T3, a to buď neošetřených, nebo ošetřených PDGFβ. Stimulace PDGFβ vede k fosforylaci AKT (tečkovaný červený obrys).
Výhody:
– Multiplexní detekce proteinů (desítky až tisíce různých proteinů analyzovaných současně)
– Membránové soupravy (arrays) využívají běžné laboratorní vybavení (chemiluminiscenční detektor)
– Možnost výběru z více platforem souprav (arrays)
– Může vyžadovat nízkou až střední úroveň dovedností v závislosti na zvolené platformě soupravy (array)
– Sběr dat je obvykle dokončen za méně než 1 den
– Jednoduchá interpretace dat
Nevýhody:
– Mohou vyžadovat neobvyklé laboratorní vybavení (skleněné matrice s kompatibilním laserovým skenerem, matrice na bázi kuliček s průtokovým cytometrem)
– Nízká propustnost (throughput) (tj. několik až 100 vzorků analyzovaných najednou)
– Žádné kvantitativní údaje pro detekci fosforylovaných proteinů
– Extrakce dat o intenzitě signálu vyžaduje specifický software
– Extrakce dat intenzity signálu může být časově náročná v závislosti na hustotě pole soupravy (array)
– Rozlišení mezi různými izoformami proteinů nemusí být možné
– Závislost na protilátce
Hmotnostní spektrometrie (MS)
Při běžném přístupu MS „zdola nahoru“ se proteiny štěpí na peptidy, které se pak před analýzou hmotnostní spektrometrií ionizují. Pomocí sestavené databáze „peptidů k proteinům“ se každý peptid přiřadí k proteinu na základě jeho hmotnosti a fragmentace. Detekce proteinů s nízkou abundancí (např. fosforylovaných proteinů) může být během procesu detekce maskována vysoce abundantními proteiny. Proto se nabohacení fosforylovaných peptidů před MS analýzou běžně provádí pomocí fosfo-specifických protilátek nebo oxidu titaničitého. [27,28] V závislosti na předcházející přípravě vzorku a matrici lze pomocí MS identifikovat více než 5 000 proteinů v rámci jedné analýzy. Pomocí MS lze získat semikvantitativní (relativní násobné změny) a kvantitativní údaje (koncentrace proteinů) bez ohledu na stav fosforylace.
MS má tři výrazné rozdíly ve srovnání s western bloty a metodou ELISA. Zaprvé, lze identifikovat nové fosforylační události, protože MS se nespoléhá na protilátky. Tento typ analýzy je považován za „bezhypotézový“ nebo „nezaujatý“. Za druhé, western bloty a ELISA mají úzký dynamický rozsah 2 až 3 řádů, zatímco MS má dynamický rozsah až 5 řádů, což umožňuje detekci fosforylovaných proteinů při nižších koncentracích. [29,30] A konečně, lze od sebe snadno odlišit izoformy proteinů.
Výhody:
– Multiplexní detekce proteinů
– Sběr dat je obvykle dokončen za méně než 1 den
– Nezávislost na protilátkách (tj. nestrannost)
– Velký dynamický rozsah
– Schopnost rozlišit různé izoformy proteinů
– Vysoká citlivost
– Možnost získání kvantitativních údajů
Nevýhody:
– Vyžaduje nabohacení fosforylovaných proteinů
– Vyžaduje drahé a neobvyklé laboratorní vybavení (hmotnostní spektrometr)
– Složitá interpretace dat vyžaduje specializovaný software
– Obsluha hmotnostního spektrometru vyžaduje specializované školení
– Nízká propustnost (throughput) (tj. několik málo až desítek vzorků analyzovaných za méně než 1 den)
Závěry
(Převzato od společnosti RayBiotech, redakčně upraveno.)
Literatura:
- Ardito F, et al. The crucial role of protein phosphorylation in cell signaling and its use as targeted therapy (Review). Int J Mol Med. 2017 Aug;40(2):271-280.
- Fuhs SR, Hunter T. pHisphorylation: the emergence of histidine phosphorylation as a reversible regulatory modification. Curr Opin Cell Biol. 2017 Apr;45:8-16
- Ardito F, et al. The crucial role of protein phosphorylation in cell signaling and its use as targeted therapy (Review). Int J Mol Med. 2017 Aug;40(2):271-280.
- Kurochkina N, et al. Phosphorylation, dephosphorylation, and multiprotein assemblies regulate dynamic behavior of neuronal cytoskeleton: a mini-review. Front Mol Neurosci. 2018 Oct 8;11:373.
- Chong H and Guan K. Regulation of Raf through phosphorylation and N terminus-C terminus interaction. The Journal of Biological Chemistry. 2003; 278, 36269-36276.
- Jaumot M and Hancock JF. Protein phosphatases 1 and 2A promote Raf-1 activation by regulating 14-3-3 interactions. Oncogene. 2001 Jul 5;20(30):3949-58.
- Han S and Meier KE. Integrated modulation of phorbol ester-induced Raf activation in EL4 lymphoma cells. Cell Signal. 2009 May;21(5):793-800.
- Kinoshita E, et al. Separation and detection of large phosphoproteins using Phos-tag SDS-PAGE. Nat Protoc. 2009;4(10):1513-21.
- Gauci VJ, et al. Quantitative proteomics: assessing the spectrum of in-gel protein detection methods. J Chem Biol. 2011; 4:3–29.
- Kinoshita E, et al.Recognition of phosphate monoester dianion by an alkoxide-bridged dinuclear zinc(II) complex. Dalton Trans., 2004; 1189-1193.
- Brady PN and Macnaughtan MA. Evaluation of colorimetric assays for analyzing reductively methylated proteins: biases and mechanistic insights. Anal Biochem. 2015 December 15; 491: 43–51.
- Bass JJ, et al. An overview of technical considerations for Western blotting applications to physiological research. Scand J Med Sci Sports. 2017 Jan; 27(1): 4–25.
- Kurosawa N, et al. Novel method for high-throughput production of phosphorylation site-specific monoclonal antibodies. Scientific Reports. 2016; 6(25174).
- Shih HH, et al. An ultra-specific avian antibody to phosphorylated tau protein reveals a unique mechanism for phosphoepitope recognition. The Journal of Biological Chemistry. 2012; 287, 44425-44434.
- Lind J, et al. Systematic analysis of phosphotyrosine antibodies recognizing single phosphorylated EPIYA-motifs in CagA of East Asian-type Helicobacter pylori strains. BMC Microbiology. 2016; 16(201).
- Kondo Y, et al. Sensitive detection of fluorescence in western blotting by merging images. PLoS One. 2018; 13(1): e0191532.
- Silva JM and McMahon M. The fastest Western in town: a contemporary twist on the class Western blot analysis. J Vis Exp. 2014 Feb 5;(84):e51149.
- Harris VM. Protein detection by Simple Western™ analysis. Methods Mol Biol. 2015;1312:465-8.
- Krutzik PO, et al. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 2004 Mar;110(3):206-21.
- Karra AS, et al. Assaying Protein Kinase Activity with Radiolabeled ATP. J Vis Exp. 2017; (123): 55504.
- Lebakken CS, et al. Development and applications of a broad-coverage TR-FRET-based kinase binding assay platform. J Biomolecular Screening. 2009; 14(8): 924-935.
- Kiening M, et al. Microplate-based screening methods for the efficient development of sandwich immunoassays. Analyst. 2005 Dec;130(12):1580-8.
- Division of Malaria and Parasitic Diseases. World Health Organization. The enzyme-linked immunosorbent assay (ELISA). Bull World Health Organ. 1976; 54(2): 129–139.
- Kingan TG. A competitive enzyme-linked immunosorbent assay: applications in the assay of peptides, steroids, and cyclic nucleotides. Anal Biochem. 1989 Dec;183(2):283-9.
- Huang W, et al. Integration of antibody array technology into drug discovery and development. Assay Drug Dev Technol. 2018 Feb/Mar;16(2):74-95.
- Huang W, et al. New insights into the tumor microenvironment utilizing protein array technology. Int J Mol Sci. 2018 Feb; 19(2): 559.
- Wang MC, et al. Optimization of titanium dioxide and immunoaffinity-based enrichment procedures for tyrosine phosphopeptide using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Anal Bioanal Chem. 2015 Feb;407(5):1343-56.
- Stokes MP, et al. PTMScan direct: identification and quantification of peptides from critical signaling proteins by immunoaffinity enrichment coupled with LC-MS/MS. Mol Cell Proteomics. 2012 May;11(5):187-201.
- Wilson R. Sensitivity and specificity: twin goals of proteomics assays. Can they be combined? Expert Review of Proteomics. 2013; 10:2, 135-149
- Koopmans F, et al. Comparative analyses of data independent acquisition mass spectrometric approaches: DIA, WiSIM-DIA, and untargeted DIA. Proteomics. 2018 Jan; 18(1): 1700304.